Брошюра
В.Г. Беспалов, В.Б. Некрасова, И.А. Шевченко, А.С. Вершинин
Провитам – биоактивный комплекс из хвои сосны и ели

Санкт-Петербург 2012
Препарат ПРОВИТАМ в каталоге >>
Скачать брошюру в PDF-формате>>
Аннотация
Беспалов В.Г., Некрасова В.Б., Шевченко И.А., Вершинин А.С. Провитам – биоактивный комплекс из хвои сосны и ели. – СПб.: Издательство 2012. В книге представлены сведения о натуральном средстве Провитаме, содержащем комплекс биологически активных веществ, выделенных по специальной технологии из хвои сосны и ели. Дается обзор основных действующих веществ Провитама: фитостеринов, витамина Е, каротиноидов, витамина К, полипренолов, сквалена, фитола. Представлены результаты изучения Провитама в кардиологии, онкологии, паразитологии. Провитам рекомендуется для восполнения дефицита в питании фитостеринов, витамина Е и каротиноидов, для профилактики и в комплексном лечении сердечно-сосудистых заболеваний, для снижения риска онкологических заболеваний, для усиления иммунной защиты, для профилактики и в комплексном лечении описторхоза.
Книга рассчитана на врачей различных специальностей, а также будет полезна широкому кругу читателей, интересующихся вопросами правильного питания и сохранения здоровья.
В.Г. Беспалов, д.м.н., академик МАНЭБ, руководитель лаборатории химиопрофилактики рака и онкофармакологии ФГБУ "НИИ онкологии им. Н.Н.Петрова" Минздравсоцразвития России, Санкт-Петербург
В.Б. Некрасова, д.т.н., академик МАНЭБ, профессор кафедры химии древесины и лесохимических продуктов Санкт-Петербургской государственной лесотехнической академии им. С.М. Кирова
И.А. Шевченко, д.м.н., профессор ФГБУ "Федеральный центр сердца, крови и эндокринологии им. В.А.Алмазова" Минздравсоцразвития России, Санкт-Петербург
А.С. Вершинин, к.м.н., ведущий научный сотрудник ФГБУ "Федеральный центр сердца, крови и эндокринологии им. В.А. Алмазова" Минздравсоцразвития России, Санкт-Петербург
Содержание
Введение
1. Характеристика Провитама
2. Свойства основных ингредиентов Провитама
2.1. Фитостерины
2.2. Витамин Е
2.3. Каротиноиды
2.4. Витамин К
2.5. Полипренолы
2.6. Сквален
2.7. Фитол
3. Изучение Провитама в кардиологии
4. Изучение Провитама в онкологии
4.1. Провитам для предупреждения канцерогенеза легких
4.2. Провитам для предупреждения рака предстательной железы
5. Изучение Провитама в паразитологии
Заключение
Литература
 Условные сокращения
Условные сокращения
АГ – артериальная гипертензия
АУП – адекватный уровень потребления
БАВ – биологически активные вещества
БАД – биологически активная добавка к пище
ГБ – гипертоническая болезнь
ИБС – ишемическая болезнь сердца
ИЭ – интенс-эффективность
КПХ – концентрат Провитаминный хвойный
КХ – концентрат хвойный
ЛПВП – липопротеиды высокой плотности
ЛПНП – липопротеиды низкой плотности
ЛТА – Санкт-Петербургская государственная лесотехническая академия им. С.М.Кирова
N-метил- N-нитрозомочевина – МНМ
ПНЖК – полиненасыщенные жирные кислоты
ПОЛ – перекисное окисление липидов
Простатическая интраэпителиальная неоплазия – ПИН
Рак предстательной железы – РПЖ
Смесь эфиров тестостерона – СЭТ
ТГ – триглицериды
ХС – холестерин
Введение
В середине 20 века Федор Тимофеевич Солодкий, профессор ЛТА, создал новое научное направление – лесобиохимию. Трудами Ф.Т.Солодкого, А.Л.Агранат, их учеников и последователей разработана научная концепция переработки и использования хвои сосны и ели для получения ценных БАВ, которые восполняют дефицит витаминов и минеральных веществ в питании, защищают организм от патогенной микрофлоры, помогают адаптации к неблагоприятным факторам окружающей среды. Одной из субстанций, получаемых по методу Ф.Т. Солодкого, является КПХ.
Во время Великой Отечественной войны в ЛТА под руководством Ф.Т. Солодкого и А.Л. Агранат был создан цех по переработке древесной зелени. КПХ, наряду с другими концентратами и экстрактами из хвои, использовали в блокадном Ленинграде в госпиталях для спасения раненых, обмороженных, истощенных голодом и восстановления жизненных сил блокадников. В послевоенное время КПХ производили в Лисинском учебно-опытном лесхозе ЛТА, а затем и в других лесохимических цехах СССР (г.Стренчи Латвийской ССР, г.Выру Эстонской ССР). В 60–80-х годах 20века в СССР было построено 14 предприятий для получения натуральной витаминной продукции из хвои сосны и ели по методу Ф.Т.Солодкого: в РСФСР, на Украине, в Белоруссии и Прибалтике [20]. Но только три цеха производили КПХ (Лисинский, Стренческий, Выруский). После распада СССР большая часть цехов по переработке хвои была закрыта. В настоящее время в России производят КПХ на Тихвинском лесхимзаводе и в Лисинском учебно-опытном лесхозе ЛТА.
В начале 50-х годов прошлого века КПХ был испытан в клиниках Ленинграда и Москвы для внутреннего и наружного применения. Результаты испытаний опубликованы в работе Ф.Т.Солодкого [17]. Масляный раствор КПХ применяли для лечения ожогов и поверхностных ран для стимулирования эпителизации, ускорения заживления, в том числе при радиационных ожогах, вяло-заживающих ранах и язвах; в виде средства для спринцевания при кольпитах, вульвовагинитах, эрозии шейки матки, а также внутрь для снижения уровня холестерина и липопротеидов в крови у больных с нарушениями липидного обмена [9,17].
В те же годы Ф.Т.Солодким было предложено применять КПХ в пищевых композициях в качестве профилактического витаминного средства. Однако затем фармацевтическая промышленность перешла на производство синтетических витаминов, которые практически вытеснили натуральные витаминные комплексы. Поэтому многие годы КПХ применяли только в косметической промышленности в качестве БАВ в составе гигиенических и косметических средств (ОСТ 56-32-78) [17]. В 70-х годах 20века в ЛТА началось детальное изучение состава КПХ [14, 17,18,20], которое продолжается и в наше время [15].
1. Характеристика Провитама
На основе фундаментальных исследований ЛТА, создан БАД "Провитам". Субстанцией Провитама является КХ – фактически КПХ, подготовленный для пищевых целей (Свидетельство о государственной регистрации № 77.99.11.3.У.2379.4.10 от 16.04.2010). Результаты изучения Провитама показали перспективность его использования в качестве натурального поливитаминного комплекса, восполняющего дефицит витаминов в питании, в качестве онко- и кардиопротектора. Химический состав основных ингредиентов КХ подробно изучен профессором ЛТА В.И.Рощиным с сотрудниками [14,15] и приведен в табл. 1.
Табл. 1. Химический состав КХ
|
Наименование компонента |
Содержание в % |
|
Спирты |
до 35 |
|
Альдегиды и кетоны |
до 30 |
|
Углеводороды |
до 30 |
|
Фитол |
20–22 |
|
Каротиноиды |
до 10 |
|
в том числе β-каротин |
до 0,4 |
|
Стерины |
2,6–3,0 |
|
Витамин Е |
около 1 |
Основными компонентами КХ являются высокомолекулярные спирты (стерины, алифатические спирты) – более 50% – и их сложные эфиры с высокомолекулярными жирными кислотами – более 30%. Остальные компоненты, %: полиоксисоединения – 8,7; углеводороды – 4,9 (алканы, терпены); альдегиды – 2,8; оксиды – 0,2 [14]. Химический состав одного из промышленных образцов КХ приведен ниже, %: неомыляемые вещества – 74,9; связанные кислоты – 16,6, в том числе жирные – 16,3, смоляные – следы; свободные жирные кислоты – 0,4; фитостерины (β-ситостерин, кампестерин, стигмастерин) – 7,3, в том числе свободные – 5,8 [14,15].
При сертификации Провитама в НИИ питания РАМН вКХ определено суммарно фитостеринов – 15,86%, высших алифатических спиртов – 9,5%. В составе фитостеринов идентифицированы β-ситостерин, стигмастерин и кампестерин. Мягкая технология позволяет сохранить в одном комплексе в природой созданных соотношениях пренолы, сквален и жизненно важные поливитамины и Провитамины: витамины Е и К, Провитамин D – β-ситостерин, кампестерин, Провитамин А – β-каротин, α-каротин, лютеин и другие ксантофиллы.
2. Свойства основных ингредиентов Провитама
Наиболее ценными БАВ в составе КХ являются фитостерины (β-ситостерин, кампестерин, стигмастерин); витамин Е (α-токоферол, бета-, гамма-, дельта-токоферолы, альфа-, бета-, гамма-, дельта- токотриенолы); каротиноиды (β-каротин, α-каротин, лютеин, ксантофилы); полипренолы, фитол, сквален, витамин К.
2.1. Фитостерины
Фитостерины (растительные стерины) – стероидные соединения растений, которые стабилизируют двойной слой фосфолипидов в мембране растительной клетки. Такую же функцию выполняет холестерин в животной клетке. Самый распространенный стерин высших растений – β-ситостерин (стигмаст-5-ен-3β-ол), представляет собой вторичный спирт с 29 атомами углерода – С29Н50О. В организм человека фитостерины попадают с растительной пищей, в крови больше всего содержится β-ситостерина и кампестерина. Каждая растительная клетка содержит фитостерины. Из пищевых источников наибольшее количество фитостеринов определено в нерафинированных растительных маслах, среднее – в орехах и семечках, наименьшее – в овощах и фруктах. Рекомендуемый АУП для фитостеринов в России – 240мг/сутки, в других странах – до 2 г/сутки. В экономически развитых странах среднее потребление населением фитостеринов составляет от 170 до 440мг/сутки, что говорит о широко распространенном дефиците потребления фитостеринов с пищей. Поскольку фитостерины не токсичны, не обладают раздражающим и сенсибилизирующим действием, не устанавливается предельно допустимая норма их потребления.
Структурное сходство ХС и растительных стеринов очевидно: они имеют циклопентанопергидрофенантреновый скелет (рис.1). Кампестерин, например, отличается от ХС лишь маленьким радикалом в боковой цепи – СН 3, а β-ситостерин – радикалом С 2 Н 5. Однако функции фитостеринов в организме человека совершенно другие, чем у ХС: они являются антагонистами избыточного ХС. Желательно применять натуральные фитостерины, но не их синтетические аналоги, отличающиеся по строению и пространственной конфигурации.
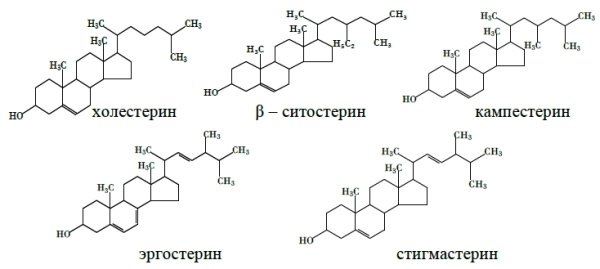
Рис. 1. Структурные формулы холестерина и фитостеринов
Фитостерины являются Провитамином D (кальциферолы), объединяющих группу родственных соединений, обладающих антирахитической активностью. Основное отличие структуры кальциферолов от других стероидных соединений состоит в наличии разомкнутого кольца и в появлении в молекуле трех сопряженных двойных связей с метиленовой группой. Основными функциями витамина D в организме является обеспечение транспорта ионов кальция и фосфора через биологические мембраны. Провитам содержащий β-ситостерин, обладает биологической активностью и нормализует липидный обмен (рис.2).
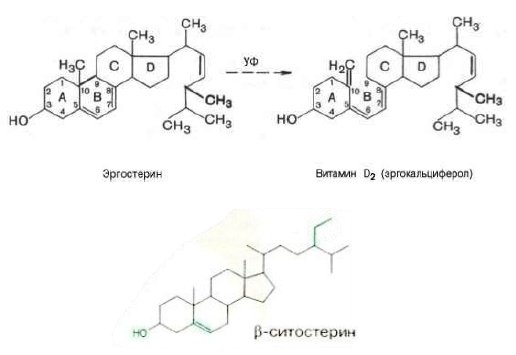
Рис.2. Витамин D2 и Провитамины
Фитостерины обладают антиатерогенной и антиканцерогенной активностью, противовоспалительным, жаропонижающим, иммуномодулирующим и антиоксидантным действием. Фитостерины подавляют секрецию провоспалительных цитокинов и фактора некроза опухолей; нормализуют реакции Т-клеточного иммунитета и подавляют избыточную выработку антител; селективно усиливают выработку Т-хелперов-1, в результате чего растет уровень интерлейкина-2 и активность естественных клеток киллеров (усиливается противоопухолевый иммунитет) и увеличивается уровень g-интерферона (усиливается противовирусный иммунитет); фитостерины также нормализуют углеводный обмен, усиливая выработку инсулина и снижая уровень глюкозы в крови [59].
Главным эффектом фитостеринов является благоприятное влияние на липидный обмен и снижение риска сердечно-сосудистых заболеваний [40]. Фитостерины конкурентно препятствуют встраиванию в мицеллы ХС, поступающего с пищей и с желчными кислотами в кишечник. Это уменьшает всасывание ХС из кишечника. Фитостерины влияют на механизмы транспорта ХС и активность ЛПНП рецепторов. Подобно холестерину, фитостерины транспортируются липопротеидами, главным образом ЛПНП, и выделяются в неизмененном виде с желчью. Благодаря этим механизмам, фитостерины снижают уровень ХС и ЛПНП в крови. Фитостерины эффективно снижают уровень ХС в крови у пациентов с умеренными и выраженными нарушениями липидного обмена и снижают риск клинической манифестации ишемической болезни сердца более чем на 20%. Анализ клинических работ показывает, что для снижения уровня ХС ЛПНП в крови и поддержания нормальной работы сердца необходимо ежедневно принимать от 0,8 до 2,0г фитостеринов как в свободной форме, так и в частично растворимой форме в виде эфиров. В 60–80-х годах прошлого века школа российских кардиологов глубоко и всесторонне изучала влияние фитостерина очищенного и β-ситостерина на нормализацию уровня ХС в крови. Было показано, что максимальный эффект получают при использовании масляных растворов фитостерина, в том числе диетических лечебных пищевых продуктов. В США рекомендуется употребление фитостеринов в дозе 2г/день для снижения уровня ХС у пациентов с нарушениями липидного обмена. По другим данным, эффективные дозы фитостеринов находятся в пределах 1,5–3,0г/сутки, при этом уровень в крови ХС ЛПНП уменьшается на 8–15%. Однако, по некоторым сведениям, даже прием фитостеринов в дозе 150мг/сутки приводит к клинически значимому уменьшению всасывания ХС из кишечника.
Вторым наиболее важным свойством фитостеринов является их антиканцерогенная и противоопухолевая активность. В эпидемиологических исследованиях повышенное потребление фитостеринов ассоциировалось со снижением риска рака толстой кишки, простаты, молочной железы, яичников, желудка, пищевода, легких. В экспериментальных работах β-ситостерин и другие фитостерины предупреждали возникновение опухолей кожи, толстой кишки, молочной железы у лабораторных грызунов. Фитостерины тормозят различные фазы канцерогенеза: инициацию, промоцию и клеточную дифференцировку, вызывать апоптоз опухолевых клеток. Фитостерины обладают также иммуностимулирующим, антиоксидантным и антиэстрогенным действием. В экспериментах β-ситостерин и другие фитостерины тормозили рост и метастазирование рака простаты и молочной железы человека, перевитого иммунодефицитным мышам.
Получить достаточное количество фитостеринов с обычными продуктами питания довольно трудно. Поэтому рекомендуется увеличить потребление фитостеринов с помощью специальных продуктов функционального питания и БАД, таких как Провитам. В Провитаме фитостерины растворены в липидном концентрате хвои, т.е. находятся в легко усваиваемой форме.
2.2. Витамин Е
Витамин Е включает 8 различных соединений, синтезируемых растениями: α‑, β‑, γ‑, δ‑токоферолы и α‑, β‑, γ‑, δ‑токотриенолы. Чаще всего встречающимся и наиболее активным является D ‑ a ‑токоферол. Витамин Е является активным антиоксидантом в липидной фазе: он разрушает цепную реакцию перекисного окисления липидов. Благодаря своему антиоксидантному действию, витамин Е стабилизирует клеточные мембраны и активные биомолекулы. Витамин Е также стабилизирует геном, регулирует активность генов и клеточные сигналы, стимулирует иммунные реакции, нормализует баланс половых гормонов, модифицирует активность различных ферментов. АУП витамина Е составляет 15мг/сутки. По результатам проведенных исследований, витамин Е наиболее перспективен для профилактики сердечно-сосудистых заболеваний, злокачественных опухолей и дегенеративных заболеваний, связанных с оксидантным повреждением [61].
Витамин Е уменьшает содержание в крови окисленных ЛПНП, снижает вероятность развития атеросклеротических поражений в сосудах любой локализации. Кроме того, витамин Е препятствует агрегации тромбоцитов, так как тромбоксан образуется путем перекисного окисления, а витамин Е подавляет этот процесс [45]. В крупных когортных эпидемиологических исследованиях повышенное потребление природного витамина Е с пищей ассоциировалось со снижением риска инфаркта миокарда, инсульта и поражений периферических артерий. Однако в последующих рандомизированных крупномасштабных исследованиях по первичной и вторичной профилактике сердечно-сосудистых заболеваний прием витамина Е не оказывал положительного действия. Одно из объяснений связано с тем, что эффект зависит от происхождения и состава витамина Е: натуральный витамин Е содержит токоферолы и токотриенолы, тогда как синтетический витамин Е – только токоферол. Токоферолы являются анитиоксидантами для ЛПНП, но активными окислителями для ЛПВП. Поэтому синтетический витамин Е может повышать фактор атерогенности, снижая уровень ЛПВП, та как последние быстро окисляются. Положительный эффект следует ожидать только от натурального витамина Е. Провитам является богатым источником натурального витамина Е, в нем сконцентрированы токоферолы и токотриенолы в природой созданных соотношениях, поэтому Провитам эффективен для предупреждения и в комплексном лечении сердечно-сосудистых заболеваний.
В эпидемиологических исследованиях показано, что повышение содержания витамина Е в крови снижает риск злокачественных опухолей в целом и отдельно рака пищевода, желудочно-кишечного тракта, молочной железы, легкого, меланомы кожи [30]. Антиканцерогенное действие БАД, содержащих витамина Е, доказано в двух крупных клинических интервенционных исследованиях. В Китае, в провинции Ланкшон, население которой имеет ряд пищевых дефицитов и высокий риск рака пищевода и желудка, витамин Е в комбинации с селеном и β-каротином снижал общую смертность от рака, особенно от рака желудка [29]. В Финляндии токоферол снижал частоту и смертность от рака простаты у мужчин-курильщиков [42]. В экспериментальных исследованиях витамин Е тормозил возникновение и развитие опухолей молочной железы, толстой кишки, ротовой полости, пищевода, кожи, подкожных сарком, желудка, слухового прохода, печени, индуцированных различными химическими канцерогенами у животных [47]. Однако в крупном рандомизированном исследовании ATBS прием синтетического витамина Е не предупреждал развитие рака легкого у курильщиков [12]. Химический состав натурального витамина Е (рис. 3) значительно отличается от состава синтетического аналога. Основной компонент альфа-токоферол имеет другую пространственную конфигурацию, а 7 других искусственных молекул (токоферол-1 – токоферол-7) отличаются от токоферолов и токотриенолов натурального витамина Е (табл.3). Это является еще одним поводом усомниться в целесообразности применения синтетических витаминов и необходимости применения Провитама в качестве натурального источника витамина Е.
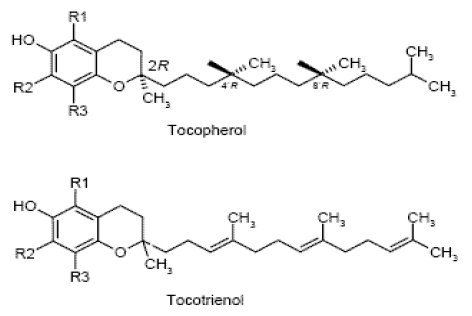
Рис. 3 α-токоферол и α-токотриенол
Табл.3. Состав натурального витамина Е и его синтетического аналога
|
Компоненты натурального витамина Е |
Компоненты синтетического витамина Е |
|
α–токоферол + 7 других природных молекул: |
α-токоферол + 7 других искусственных молекул |
|
бета-токоферол |
токоферол-1 |
|
гамма-токоферол |
токоферол-2 |
|
дельта-токоферол |
токоферол-3 |
|
альфа-токотриенол |
токоферол-4 |
|
бета-токотриенол |
токоферол-5 |
|
гамма-токотриенол |
токоферол-6 |
|
дельта-токотриенол |
токоферол-7 |
Натуральный витамин Е защищает от нейродегенеративных заболеваний. Повышенное потребление витамина Е с пищей снижает риск болезни Паркинсона и болезни Альцгеймера. Витамин Е также оказывает положительное действие при лечении болезни Альцгеймера и других нейродегенеративных заболеваний [49]. У больных после травм и хирургических вмешательств дополнительный прием витамина Е улучшает результаты лечения; у больных вирусным гепатитом дополнительное назначение витамина Е уменьшает вирусную нагрузку; у больных ревматоидным артритом назначение витамина Е уменьшает клинические проявления болезни [12].
2.3. Каротиноиды
Каротиноиды – жирорастворимые растительные пигменты. К ним относятся циклические углеводороды – каротины и кислородсодержащие производные – ксантофиллы (рис.4).
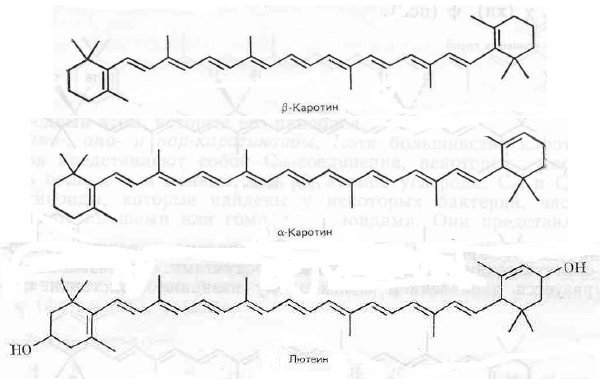
Рис.4. Каротиноиды
Одной из характерных особенностей каротиноидов является наличие системы конъюгированных или сопряженных двойных связей, образующих хромоформные группы, от которых зависит окраска – желтая или оранжевая. Характерным представителем каротиноидов является β-каротин (С40Н56), молекула которого содержит 11 двойных связей, в том числе две связи входят в кольцо β-ионона. Природный β-каротин содержится в смеси с другими каротиноидами, окрашенными в цвета от желтого до оранжевого. Синтетический каротин обычно моносоединение, окрашенное в красный цвет. Каротиноиды относятся к тетратерпенам. Изомерами β-каротина являются α- и γ-каротины, ксантофиллы. Отличием α-каротина (С40Н56) является положение двойной связи в одном из циклов, расположенным по концам молекулы, которая ассиметрична. Ксантофиллы – кислородсодержащие каротиноиды. Преобладающим в количественном отношении ксантофиллом хвои является лютеин (С 40 Н 56 О 2), определены также виолаксантин, неоксантин и другие ксантофиллы.
Каротиноиды являются Провитамином А – ретинола, (рис.5), встречающегося только в органах и тканях животных.
Рис.5. Витамин А
Каротиноиды обладают многообразными механизмами действия, активно влияющими на здоровье человека. Главное в механизмах действия каротиноидов – антиоксидантное действие в липидной фазе путем подавления активности синглетного кислорода и удаления свободных радикалов; предотвращение повреждения генома и клеточных мембран свободными радикалами. Каротиноиды также регулируют различные биохимические клеточные сигналы; модулируют ферменты цитохрома Р450; ингибируют метаболизм арахидоновой кислоты; стимулируют Т- и В‑клеточный иммунитет, выработку интерферона, активность макрофагов и естественных клеток-киллеров и другие иммунные реакции; тормозят экспрессию онкогенов; предотвращают нестабильность хромосом; тормозят пролиферацию, индуцируют дифференцировку и апоптоз опухолевых клеток. β-каротин и ряд других каротинов превращаются в организме в витаминА [33]. Каротиноиды защищают кожу от повреждающего действия ультрафиолета и фотостарения. Лютеин и зеаксантин обеспечивают желтую окраску пятна сетчатки глаза и нормальное функционирование зрительного анализатора.
Каротиноиды являются наиболее перспективными для снижения риска злокачественных опухолей, сердечно-сосудистых заболеваний, болезней глаз и других дегенеративных патологий, связанных с оксидантным повреждением. АУП каротиноидов в сутки составляет 15мг, в том числе для β-каротина – 5мг, ликопина – 5 мг, лютеина – 5 мг, зеаксантина – 1 мг, астаксантина – 2 мг.
β-каротин и другие каротиноиды – известные антиканцерогенные агенты. В эпидемиологических исследованиях повышенное потребление β-каротина и других каротиноидов – ликопина, ксантофиллов лютеина и зеаксантина – снижало риск рака различных локализаций. β-каротин, назначаемый в виде БАД в течение от 3мес до 4лет, оказывал благоприятное действие на предраковые состояния и изменения различных органов: снижал риск рецидивов аденом толстой кишки, вызывал регрессию лейкоплакий ротовой полости и дисплазии шейки матки, тормозил прогрессирование хронического эзофагита. Прием β-каротина в виде БАД у мужчин с изначально низким его потреблением с пищей снижал риск рака простаты.
По результатам данных интервенционных исследований можно сделать вывод, что β-каротин снижает онкологический риск при дополнительном приеме его на фоне хронического дефицита каротиноидов в питании; при достаточном потреблении каротиноидов с пищей β-каротин не проявляет онкопрофилактического действия. Возможно, использование смеси природных каротиноидов более перспективно для химиопрофилактики рака по сравнению с синтетическим β-каротином.
Каротиноиды встраиваются в структуру липопротеидов крови и ингибируют процесс их окислительной модификации. Включение β-каротина в диету человека приводило к ингибировании окислительной модификации ЛПНП. В популяционных эпидемиологических исследованиях повышенное потребление β-каротина, ликопина, ксантофиллов и других каротиноидов с пищей ассоциировалось с замедлением прогрессирования атеросклероза и снижением риска инфаркта миокарда и инсульта. Однако мета-анализы интервенционных исследований показали, что дополнительный прием β-каротина не предотвращает сердечно-сосудистые заболевания. По-видимому, для эффективной профилактики сердечно-сосудистых заболеваний необходимо использовать комплекс различных каротиноидов, а не один β-каротин.
Повышенное употребление с пищей ксантофиллов (лютеина, зеаксантина, криптоксантина, астаксантина) ассоциируется со снижением риска возрастной дегенерации желтого пятна сетчатки глаза и катаракты [62]. В рандомизированных исследованиях прием β-каротина или комбинации β-каротина с другими антиоксидантами замедлял прогрессирование возрастной дегенерации сетчатки. Каротиноиды снижают риск сахарного диабета, нейродегенеративных заболеваний, подавляют инфекцию Helycobacter pylori, поддерживают нормальную работу простаты и функциональное состояние кожи, защищают от нейродегенеративных заболеваний [12].
Еще раз следует обратить внимание на то, что природный Провитамин А в Провитаме отличается от синтетического аналога. В Провитаме – комплекс каротиноидов от желтого до оранжевого цвета, в числе которых β-каротин, а синтетический аналог красного цвета – синтезированный β-каротин.
На наш взгляд, необходимо обратить серьезное внимание на то, что накоплено большое количество негативных данных относительно синтетических витаминов А, Е и β-каротина: из-за их применения может увеличиваться риск инсультов, инфарктов и рака.Провитам содержит комплекс натуральных каротиноидов в сочетании с витамином Е (токоферолы и токотриенолы), Провитамином D (фитостерины), другими БАВ, что более полезно для организма.
2.4. Витамин К
Витамины группы К распространены в природе и представлены двумя рядами хинонов – филлохинонами (витамины К 1) и менахинонами (витамины К 2). Хвоя сосны и ели содержит 10–16 мг/кг витамина К 1 (рис.6).
Рис.6. Филлохинон – витамин К1
Витамин К необходим для регулирования процесса свертывания крови. Кроме того, результаты эпидемиологических исследований свидетельствуют, что повышенное потребление витамина К с пищей снижает риск сердечно-сосудистых заболеваний, инсульта, остеопороза, переломов. У витамина К выявлена также противоопухолевая активность.
2.5. Полипренолы
Полипренолы и их 2,3‑дигидропроизводные (долихолы) – длинноцепочечные спирты, состоящие из изопреновых остатков (рис. 7), являются природными биорегуляторами и присутствуют в малых количествах в различных растительных и животных тканях. В растениях присутствуют, главным образом, полипренолы, в животных организмах – долихолы. В полипренолах все изопреновые звенья ненасыщенные. Долихолы имеют насыщенное a - изопреновое звено.
Рис. 7. Полипренолы
Полипренолы, попадаемые с растительной пищей в животный организм, метаболизируются в печени в активные долихолы. Функция полипренолов заключается в связывании и переносе олигосахаридов от нуклеотидфосфосахаров к полипептидам (или протеинам) и образовании их комплексов. Этот процесс является общим для клеток всех живых организмов, его нарушение приводит к расстройству жизнедеятельности. Наиболее важной природной функцией полипренолов является участие в гликозилировании протеинов и протеидов, что особенно важно для мембранообразующих белков. Гликозилирование протеинов обеспечивает их защиту от протеолиза в процессе синтеза и транспорта к месту функционирования, позволяет узнавать то место мембраны, в которое они должны встраиваться. Антитела, вырабатываемые В-лимфоцитами, также в своих активных центрах, отвечающих за взаимодействие антител с антигенами и рецепторами, имеют углеводные участки. Долихолы содержатся в мембранах клеток, где они выполняют антирадикальную роль, удаляя переокисленные липиды; долихолы стереохимически взаимодействуют с витаминомЕ, образуя транспортные цепи по удалению свободных радикалов.
Интерес к полипренолам и долихолам во всем мире связан с проявлением ими разноообразных видов биологической активности при полном отсутствии побочных эффектов и крайне низкой токсичности. Полипренолы обладают иммунорегулирущей, противоязвенной, ранозаживляющей активностью, восстанавливают функцию печени, понижают содержание холестерина в крови, стимулируют репарацию клеток и сперматогенез.
Изучены некоторые направления применения полипренолов из хвои в медицине. Известно, что состояние акросомы определяет уровень протеолитической активности сперматозоида и что акросома в процессе сперматогенеза развивается как секреторная гранула от пузырька пластинчатого комплекса (аппарат Гольджи), а полипренолы являются сырьем для комплекса. Изучено влияние полипренолов на сперматогенез у старых и молодых животных с нарушением репродуктивной функции. Введение полипренолов внутрижелудочно больным животным приводило к стабилизации и обратному течению патологического процесса: возрастал с 2,5 (у больных) до 3,7 (после лечения) индекс сперматогенеза, более чем в 2 раза увеличивалось количество нормальных сперматозоидов, восстанавливались семяродные эпителиальные клетки канальцев семенников, увеличивалась масса семенников, значительно улучшалось функциональное состояние сперматозоидов. Установлено, что в группах самок, спаренных с самцами, прошедшими лечение полипренолами, оплодотворение наступало у 75,7% животных, тогда как в группах нелеченных животных – в 8,3% случаев.
Изучение влияния полипренолов на иммунную систему организма показало, что они являются иммуномодулирующими веществами, избирательно воздействующими на гуморальное звено иммунного ответа и на неспецифичкскую фагоцитарную активность макрофагов. Это может быть использовано при лечении различных нарушений равновесия в иммунной системе. Полипренолы при введении перед заражением мышей вирусом гриппа защищали животных от данной вирусной инфекции. Полипренолы рекомендуются для профилактики и лечения заболеваний, обусловленных иммунодефицитами.
На модели экспериментальной хронической язвы было показано, что полипренолы и содержащие их продукты, такие как КХ, обладают противоязвенным действием, притом более эффективным, чем облепиховое масло. При лечении полипренолами образовывалось большое количество слизистых желез в желудке, с чем, вероятно, связано более быстрое заживление; у животных не было обнаружено многокамерных кист, перфорации и спаек с другими органами брюшной полости.
Полипренолы могут тормозить канцерогенез и опухолевый рост. Например, выявлено, что уровень долихола в клетках опухоли печени снижается по сравнению с нормальными клетками печени. Долихол фосфат индуцировал апоптоз клеток лейкоза и глиомы в культуре. В процессе гепатоканцерогенеза после воздействия на крыс гепатотропными канцерогенами диэтилнитрозамином или 3’-метил-4-диметиламиноазобензолом уровень долихола в печени увеличивался, что свидетельствует о выработке клетками долихола в качестве защитной реакции против канцерогенеза.
2.6. Сквален
Сквален (С 30 Н 50) (рис.8) – основной предшественник для биосинтеза тритерпенов и стероидов в животных и в растительных организмах. Первым продуктом окислительной циклизации сквалена в животных организмах является ланостерол (С 30 Н 49 ОН), который через ряд промежуточных продуктов превращается в ХС (С 27 НОН). У растений стероиды (фитостерины) также образуются из сквалена, но через циклоартенол.
Сквален нормализует липидный обмен, снижает уровень ХС в крови, уменьшает риск сердечно-сосудистых и онкологических заболеваний. В продуктах питания сквален присутствует в небольших количествах. Провитам – хороший источник сквалена.
2.7. Фитол
Фитол (С20Н39ОН) я вляется изопреноидом, высокомолекулярным непредельным спиртом. Именно наличие остатка фитола в хлорофилле придает ему липидные свойства, проявляющиеся в его растворимости в жировых растворителях. Фитол, как и каротиноиды, образуется из общих предшественников, основной структурной единицей которого является изопрен представляет из себя длинноцепочечный алифатический спирт (рис.9), входит в химическую структуру молекул токоферолов, хлорофилла, витаминаК. Например, длинная боковая цепь витамина К1 является остатком высокомолекулярного алифатического спирта фитола, входящего в состав хлорофилла.
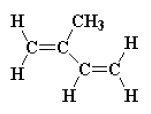
Рис.9. Изопрен
Фитол является лигандом для клеточных ядерных рецепторов PPAR и активирует данные рецепторы. Активация рецепторов PPAR в клетках является антипролиферативным, антиангиогенным и продифференцирующим сигналом для многих тканей. Например, ф итол, добавляемый в культуру клеток, индуцировал апоптоз и тормозил рост клеток лимфоидного лейкоза человека и мыши. Фитол способствует нормализации липидного обмена.
Рис.10. Фитол
3. Изучение Провитама в кардиологии
В ФГБУ "Федеральный центр сердца, крови и эндокринологии им. В.А.Алмазова" Минздравсоцразвития России была проведена клиническая апробация БАД "Провитам" в комплексной терапии больных с заболеваниями сердечно-сосудистой системы и нарушением липидного обмена. В процессе длительного наблюдения (3 месяца) изучали влияние Провитама на общее состояние и самочувствие больных, особенности и характер изменений показателей липидного обмена и продуктов ПОЛ. Для изучения клинической эффективности Провитам назначали больным, находившимся на лечении в клинике по поводу ИБС и АГ (табл. 4 и 5). Средняя продолжительность заболевания у больных основной группы составила 10,8 лет, в контрольной группе – 7,8 лет.
Табл.4. Пол и возраст больных основной и контрольной групп
|
Возраст, лет |
30-39 |
40-49 |
50-60 |
Всего |
% |
|||||
|
осн. гр. |
контр. гр. |
осн. гр. |
контр. гр. |
осн. гр. |
контр. гр. |
осн. гр. |
контр. гр. |
осн. гр. |
контр. гр. |
|
|
Мужчины |
1 |
- |
2 |
2 |
6 |
3 |
9 |
5 |
30,0 |
33,3 |
|
Женщины |
1 |
1 |
4 |
3 |
16 |
6 |
21 |
10 |
70,0 |
66,7 |
|
Всего |
2 |
1 |
6 |
5 |
22 |
9 |
30 |
15 |
100,0 |
100,0 |
|
Процент, % |
6,7 |
6,7 |
20,0 |
33,3 |
73,3 |
60,0 |
100,0 |
100,0 |
100,0 |
100,0 |
Табл.5. Диагнозы и продолжительность заболевания больных основной и контрольной групп
|
Наименование заболеваний |
Число больных |
Средняя продолжительность заболевания (лет) |
||
|
осн. гр. |
контр. гр. |
осн. гр. |
контр. гр. |
|
|
ИБС:
|
6 |
2 |
7,0 |
6,1 |
|
2 |
3 |
9,4 |
8,3 |
|
|
3 |
– |
6,8 |
– |
|
|
ИБС с ГБ |
13 |
6 |
12,4 |
9,5 |
|
ГБ |
6 |
4 |
8,5 |
7,3 |
|
ВСЕГО |
30 |
15 |
10,8 |
7,8 |
При анализе результатов проведенного обследования у большинства больных основной группы отмечено улучшение самочувствия и общего состояния. У лиц, страдающих стенокардией, уменьшилась частота и интенсивность болевых приступов, улучшились результаты ЭКГ-исследования, отмечено снижение функционального класса заболевания и повышение толерантности к физической нагрузке. Практически у всех больных ГБ, на фоне улучшения самочувствия, уменьшения головных болей и головокружения выявлено снижение артериального давления.
Естественно, что положительные результаты лечения были достигнуты благодаря комплексному применению всех клинических лечебных факторов: режим, диета, медикаментозная терапия (антиангинальные, гипотензивные, симптоматические и другие средства), а также в результате приема Провитама.
Непосредственное влияние Провитама на липиды оценивали по характеру и величине изменений показателей липидного обмена до- и после курсового (месячного) его приема. В результате месячного приема Провитама уровень общего холестерина, ТГ, ХС ЛПНП у больных основной группы практически не изменился, как и у больных контрольной группы (табл.6). Однако в основной группе уровень ХС ЛПВП увеличился на 24,2%, коэффициент атерогенности снизился на 7,96%, тогда как показатели липидного обмена у больных контрольной группы достоверно в течение месяца не изменились. В основной группе у отдельных лиц улучшились электрокардиографические данные, состояние гемодинамики и повышение толерантности к физической нагрузке. До- и после лечения не выявлено существенных отклонений функционального состояния печени, почек, свертывающей системы крови, показателей белкового и углеводного обмена.
Табл.6. Показатели липидного обмена до- и после месячного приема Провитама
|
Наименование показателей |
До лечения |
После месячного приема Провитама |
Изменения, % |
|||
|
осн. гр. |
контр. гр. |
осн. гр. |
контр. гр. |
осн. гр. |
контр. гр. |
|
|
Общий ХС, моль/л |
6,76±0,49 |
5,93±0,35 |
6,67±0,61 |
5,91±0,89 |
↓1,4 |
↓1,0 |
|
ТГ, моль/л |
1,28±0,21 |
1,15±0,35 |
1,25±0,21 |
1,18±0,23 |
↓2,4 |
2,5 |
|
ХС ЛПВП, моль/л |
1,32±0,12* |
1,39±0,4 |
1,64±0,14* |
1,41±0,18 |
↑24,2 |
↑1,4 |
|
ХС ЛПНП, моль/л |
4,74±0,64 |
4,21±0,51 |
4,72±0,56 |
4,28±0,47 |
↓0,3 |
↑1,6 |
|
Коэффициент атерогенности |
2,89±0,56 |
3,01±0,32 |
2,66±0,39 |
3,11±0,29 |
↓7,96 |
↑3,2 |
* – достоверные различия с вероятностью p <0,05
Значения ПОЛ до- и после курсового приема Провитама показали, что суммарная антирадикальная емкость плазмы у больных основной группы повысилась на 13,5%; диеновые конъюгаты снизились на 21,7%; гидроперекиси апоВ – на 18,5%, что свидетельствует о выраженной антирадикальной активности Провитама, тогда как показатели ПОЛ у больных контрольной группы изменились несущественно (табл.7).
Табл.7. Показатели ПОЛ до- и после курсового приема Провитама
|
Наименование показателя |
До лечения |
После лечения |
Изменения, % |
|||
|
осн. гр. |
контр. гр. |
осн. гр. |
контр гр. |
осн. гр. |
контр. гр. |
|
|
Суммарная антирадикальная емкость плазмы, моль/л |
1,15±0,24 |
1,16±0,19 |
1,33±0,22 |
1,18±0,21 |
↑13,5 |
↑1,7 |
|
Диеновые конъюгаты, мкмоль/л |
92,20±9,89* |
87,3±7,83 |
72,26±8,20* |
85,7±6,53 |
↓21,7 |
↓1,8 |
|
Гидроперекиси Апо В, нг/мл |
6,93±0,56* |
6,81±0,47 |
5,65±0,50* |
6,51±0,49 |
↓18,5 |
↓4,6 |
* – достоверные различия с вероятностью р<0,05
При комплексной клинической оценке эффективности Провитама анализировали до- и после приема продукта состояние и самочувствие больных, данные анамнеза, результаты объективного исследования, уровень артериального давления, состояние гемодинамики, данные электро- и эхокардиографии, результаты лабораторного и инструментального исследования. Особенно большое внимание уделяли анализу показателей липидного обмена и ПОЛ. Кроме того, учитывали переносимость Провитама, побочные явления, совместимость препарата с другими лекарственными средствами в комплексной терапии ИБС и ГБ.
Клинические результаты проведенных исследований регистрировали как "хороший", "удовлетворительный" и "без эффекта". Хороший эффект устанавливали при нормализации или существенном снижении (на 10–15%) повышенных показателей липидного обмена, улучшении общего состояния больного, уменьшении интенсивности и частоты приступов ангинозных болей и снижении артериального давления. При удовлетворительном эффекте отмечали некоторое снижение повышенных показателей липидного обмена (на 5–10%), улучшение общего состояния больного. При оценке без эффекта снижения повышенных показателей липидного обмена не наблюдали. Клинические результаты применения Провитама больными основной группы были видны уже через месяц приема (табл. 8). У части больных, наряду с улучшением общего состояния и самочувствия, выявлено существенное улучшение показателей ПОЛ. При продлении курса приема Провитама до 2–3 месяцев по 2 таблетки 2 раза в день выявлен хороший клинический эффект у каждых 5 больных из 6: снижение общего ХС на 18%, триглицеридов – на 16,4%, ХС ЛПНП – на 14,8%, коэффициента атерогенности – на 11,4%; повышение ХС ЛПВП – на 19,3%; положительные изменения показателей ПОЛ: суммарная антирадикальная емкость плазмы увеличилась на 17,8%, снизились диеновые конъюгаты на 13,4%, гидроперекиси апо-В – на 19,8%.
Табл.8. Клинические результаты лечения Провитамом в течение месяца
|
Заболевание |
Число больных |
Результаты лечения |
||
|
хороший |
удовлетворительный |
без эффекта |
||
|
ИБС
|
6 |
2 |
4 |
– |
|
- стенокардия с инфарктом миокарда в анамнезе |
2 |
- |
1 |
1 |
|
- атеросклеротический кардиосклероз |
3 |
1 |
1 |
1 |
|
ИБС с ГБ |
13 |
1 |
8 |
4 |
|
ГБ |
6 |
3 |
2 |
1 |
|
ВСЕГО |
30 |
7 |
16 |
7 |
|
Процент % |
100,0 |
23,3 |
53,4 |
23,3 |
Положительный результат лечения отмечен у 76,7% больных, из них у 23% выявлен хороший и у 53,4% – удовлетворительный эффект, у 23,3% больных не было улучшения клинических и лабораторных показателей. После 3-х месячного приема Провитама отмечено значительное снижение ПОЛ и улучшение показателей липидного обмена: повышение уровня ЛПВП на 24% и снижение коэффициента атерогенности на 7,96%. Повышение суммарной антирадикальной емкости плазмы (на 13,5%) и снижение диеновых конъюгатов (на 21,7%) и гидроперекисей апо-В (на 18,5%) свидетельствуют о выраженных антирадикальных свойствах Провитама. Продукт, в основном, хорошо переносится больными, встречаются лишь единичные случаи диспептических явлений у больных с сопутствующими заболеваниями печени и желчевыводящих путей.
Провитам совместим с основными лекарственными средствами, применяемыми для лечения ИБС и ГБ. Наибольший положительный лечебный эффект достигается при приеме 4 таблеток в день (по 2 таблетки 2 раза в день) утром и вечером после еды. Повторный курс приема Провитама проводят через 3–6 месяцев. С профилактической целью Провитам назначают по 2 таблетки в день (по 1 таблетке 2 раза в день) утром и вечером после еды в течение 1 месяца 2 раза в год (весной и осенью). Провитам можно принимать в стационарах и амбулаторно-поликлинических учреждениях в комплексной терапии и профилактике сердечно-сосудистых заболеваний, сопровождающихся умеренно выраженными формами нарушений липидного обмена.
4. Изучение Провитама в онкологии
4.1. Провитам для предупреждения канцерогенеза легких
В ФГБУ "НИИ онкологии им. Н.Н.Петрова" Минздравсоцразвития России проведено изучение субстанции Провитама в качестве антиканцерогенного средства на модели канцерогенеза легких.
Для изучения антиканцерогенной активности использована модель канцерогенеза легких, индуцированного уретаном у мышей. Эксперименты проведены на мышах-самках SHR разводки питомника "Рапполово" РАМН (Ленинградская обл.). Мыши содержались в одинаковых условиях, получали корм и водопроводную воду без ограничений. Изучаемые вещества ежедневно тщательно замешивали в корм из расчета на 1кг кормовой смеси. КХ для более равномерного перемешивания перед добавлением в корм растворяли в небольшом количестве рафинированного подсолнечного масла. Это же количество рафинированного подсолнечного масла добавляли в кормовую смесь контрольных животных. Общее содержание жира в смешанном корме составляло 5–8%. Канцероген уретан получен от фирмы Sigma, USA. КХ использован производства фирмы "Фитолон-Мед" (Санкт-Петербург). Льняное масло пищевое использовано производства ООО "Вера" (г.Кашин Тверской обл.).
Мышам вводили канцероген по следующей схеме: внутрибрюшинно 10%раствор уретана в изотоническом растворе натрия хлорида по 1 г/кг массы тела, 1раз в неделю, всего 6инъекций. Мыши были разделены на 5экспериментальных групп. Введение изучаемых БАВ начинали за 2недели до инъекций уретана, вводили весь период инъекций уретана и затем – до окончания эксперимента.
Группа 1. Уретан контроль. Животные подвергались воздействию уретана, получали стандартный корм и обычную питьевую воду.
Группа 2. Уретан + КХ. Животные подвергались воздействию уретана, получали стандартный корм с добавлением КХ, 2г/кг корма, 700мг/кг массы тела в день, и обычную питьевую воду. Доза для экспериментального исследования выбрана, исходя из данных по содержанию в КХ каротиноидов, витамина Е и фитостеринов, и литературных данных по дозам данных веществ, использованных в экспериментах по изучению антиканцерогенной активности у животных.
Группа 3. Уретан + льняное масло. Животные подвергались воздействию уретана, получали стандартный корм с добавлением льняного масла, 10% с кормом, и обычную питьевую воду. Выбранная доза льняного масла выбрана в соответствии с литературными данными по изучению биологических эффектов растительных масел у животных.
Группа 4. Уретан + льняное масло с КХ. Животные подвергались воздействию уретана, получали стандартный корм с добавлением льняного масла, содержащего 2% КХ, 10% с кормом, и обычную питьевую воду. При этом доза КХ составляла 2г/кг корма, 700мг/кг массы тела в день, как и в группе2.
Группа 5. Интактный контроль. Животные не подвергались воздействию уретана, получали стандартный корм и обычную питьевую воду.
Животных всех групп забивали парами эфира через 7 месяцев от начала инъекций уретана и подвергали полной аутопсии. Органы с опухолями или подозрениями на опухолевый рост фиксировали в 10% растворе формалина. Подсчет и измерение опухолей в легких проводили сразу после вскрытия животных и выделения легких, а также затем повторно после фиксации в формалине. Гистологическая обработка органов и тканей производилась по стандартной методике с окраской гематоксилин/эозином. Патоморфологический анализ материала проводился при световой микроскопии. Патоморфологическую диагностику опухолей мышей проводили согласно критериям Международного агентства по изучению рака. Статистическую обработку результатов проводили на персональном компьютере общепринятыми статистическими методами с использованием критериев χ 2 и t (Стьюдента).
Результаты изучения влияния КХ и льняного масла на канцерогенез легких, индуцированный уретаном у мышей, представлены в табл.9.
Табл.9. Влияние КХ, льняного масла и льняного масла, обогащенного КХ, на канцерогенез легких
|
Группа |
N |
Опухоли легких: частота (%) и множественность, М ± m |
|||
|
Всего |
Аденомы диаметром в мм |
Аденокарциномы |
|||
|
1–2 мм |
³ 3мм |
||||
|
Уретан-контроль |
38 |
38 (100%) |
38 (100%) |
17 (44,7%) |
8 (20,1%) |
|
21,7 ± 2,5 |
19,9 ± 2,3 |
1,5 ± 0,4 |
0,3 ± 0,1 |
||
|
Уретан + КХ |
30 |
29 (96,7%) |
26 (86,7%) * |
9 (30%) |
4 (13,3%) |
|
10,1 ± 1,2 * |
9,4 ± 1,2 * |
0,6 ± 0,2 * |
0,4 ± 0,3 |
||
|
Уретан + льняное масло |
30 |
2 8 (9 3, 3 %) |
2 7 (90 %) |
12 (4 0%) |
4 (13,3%) |
|
23 ± 3, 6 |
20, 9 ± 3, 1 |
2 ± 0, 7 |
0,2 ± 0,1 |
||
|
Уретан + льняное масло с КХ |
30 |
28 (93,3%) |
28 (93,3%) |
11 (36,7%) |
3 (10%) |
|
11,3 ± 1,5 * |
10,2 ± 1,3 * |
0, 9 ± 0, 3 |
0,1 ± 0,08 |
||
* – достоверные различия с контролем с вероятностью p <0,05–0,001
Как видно из табл. 9, КХ существенно уменьшал все показатели развития опухолей легких: общую множественность опухолей – на 53,5 (p < 0,001), частоту и множественность аденом диаметром 1–2мм – соответственно на 13,3% (p < 0,05) и 52,8% (p < 0,001), множественность аденом легких ³ 3мм – на 60% (p < 0,05). На частоту и множественность аденокарцином легких КХ достоверно не влиял. Следовательно, КХ оказал выраженный антиканцерогенный эффект на возникновение и развитие опухолей легких, индуцированных уретаном у мышей. Антиканцерогенное действие КХ обусловлено, вероятно, синергичным эффектом комплекса антиканцерогенных веществ: фитола, фитостеринов, каротиноидов и витамина Е. КХ – удачная комбинация природных антиканцерогенных веществ, перспективная для дальнейшего изучения и внедрения в качестве средства для химиопрофилактики рака.
Льняное масло является уникальным продуктом по своему составу, в отличие от всех других растительных масел оно содержит 60–65% ПНЖК омега-3 типа, в основном a -линоленовой кислоты. Как и другие растительные масла, льняное масло богато витаминомЕ, содержание данного витамина в нем составляет 100–120мг%. Льняное масло в связи с высоким содержанием a -линоленовой кислоты и витамина Е по своим биологическим эффектам напоминает рыбий жир.
В литературе есть ряд доказательств антиканцерогенного действия льняного масла и a -линоленовой кислоты. Однако льняное масло не тормозило канцерогенез легких, индуцированный уретаном у мышей (табл. 9). Известно, что жир пищи вообще, а также ПНЖК омега-6 типа, стимулируют канцерогенез. Вероятно, стимулирующие эффекты жира и ПНЖК омега-6, содержащихся в льняном масле, не дали проявиться антиканцерогенному действию a -линоленовой кислоты и витамина Е в нашем эксперименте. В литературе имеются факты и стимулирующего действия льняного масла на канцерогенез и опухолевый рост. В эпидемиологических исследованиях потребление a -линоленовой кислоты повышало риск рака простаты, рака молочной железы. Льняное масло увеличивало частоту спонтанных опухолей молочной железы у трансгенных мышей, носителей онкогена рака молочной железы c - neu. По-видимому, антиканцерогенное действие льняного масла вовсе не является однозначным, и баланс его стимулирующего и тормозящего канцерогенез действия в зависимости от условий может склоняться как в ту, так и в другую сторону.
Льняное масло, обогащенное КХ, уменьшало показатели развития опухолей легких по сравнению с контролем: общую множественность опухолей – на 47,9% (p < 0,001), множественность аденом диаметром 1–2 мм – на 48,7% (p < 0,001) (табл. 9). Следовательно, льняное масло, обогащенное КХ, оказало антиканцерогенный эффект на возникновение и развитие опухолей легких, индуцированных уретаном у мышей. Учитывая то, что само льняное масло не оказывало модифицирующего действия на канцерогенез легких, антиканцерогенное действие льняного масла, обогащенного КХ, связано с эффектами именно данной субстанции. Представляется перспективным обогащение льняного масла и других растительных масел КХ, так как при этом комбинированный продукт приобретает новые полезные свойства, и ослабляется вредное действие растительных масел, в частности их способность стимулировать канцерогенез. КХ рекомендуется добавлять в растительные масла в количестве 2%.
4.2. Провитам для предупреждения рака предстательной железы
РПЖ – мировая социальная проблема, одно из наиболее частых и тяжелых заболеваний у мужчин в развитых странах мира. В XXI веке РПЖ стал одним из главных виновников смерти мужчин от злокачественных новообразований. РПЖ в структуре онкологических заболеваний у мужчин занимает 2-е место, в целом, на протяжении всей жизни каждому шестому мужчине будет поставлен диагноз РПЖ, а около 3% мужчин имеют шанс умереть от РПЖ. В России в последние десятилетия наблюдаются быстрые темпы роста заболеваемости и смертности от РПЖ; стандартизованный показатель заболеваемости РПЖ на 100тысяч мужского населения с 1998 по 2008 годы увеличился более чем в два раза: с 15,28 до 33,69 (прирост 120,5%); за этот же период "грубый" показатель смертности от РПЖ вырос на 57,6%.
Предшественником инвазивного РПЖ является предраковая патология – ПИН, которая характеризуется дисплазией и гиперплазией эпителиальных клеток, выстилающих ацинусы и протоки простаты. Цитологические нарушения при ПИН имитируют аналогичные нарушения при инвазивном РПЖ, но они ограничены железистыми и протоковыми компонентами. Выделяют 4 основных структурных типов ПИН: плоский, пучкообразный, микропапиллярный и крибриформный; микропапиллярный и крибриформный типы – отличительные признаки ПИН тяжелой степени; ПИН легкой степени обычно имеет плоский и пучкообразный типы]. Доброкачественная гиперплазия простаты признается в настоящее время патологическим фоном, на котором развиваются ПИН и РПЖ, встречается значительно чаще, чем РПЖ, и диагностируется у большинства мужчин старшего и пожилого возраста.
РПЖ является одной из наиболее подходящих локализаций для химиопрофилактики в связи с тем, что это одна из наиболее частых злокачественных опухолей; ПИН и микроочаги аденокарциномы имеются у большого числа здоровых мужчин; РПЖ растет очень медленно, до появления клинических симптомов имеет длительный латентный период; индолентные формы РПЖ могут длительно сдерживаться химиопрофилактикой и не переходить в агрессивную злокачественную опухоль; можно обосновано утверждать, что химиопрофилактика РПЖ показана большой части популяции мужчин]. В последние два десятилетия в мире активно ведется поиск эффективных и безопасных средств для химиопрофилактики РПЖ. Моделирование канцерогенеза простаты – самая трудная область экспериментальной онкологии. Комбинированные двухстадийные модели канцерогенеза простаты с введением в качестве инициатора канцерогена и промотора – препаратов тестостерона, позволяют смоделировать все этапы канцерогенеза простаты – доброкачественная гиперплазия, ПИН и РПЖ, и являются максимально приближенными к патологии простаты человека. В доклинических исследованиях у достаточно большого количества лекарственных препаратов, пищевых и непищевых веществ выявлена способность тормозить канцерогенез ПЖ. Однако в клинической практике на сегодняшний день для химиопрофилактики РПЖ применяется только один лекарственный препарат – ингибитор 5-α-редуктазы финастерид. Возможности применения финастерида для химиопрофилактики РПЖ достаточно ограничены в связи с недостаточной эффективностью у мужчин с уровнем ПСА в крови > 4 нг/мл в крови и серьезными побочными эффектами, связанными с антиандрогенным действием препарата. Актуальность поиска и внедрения в клиническую практику новых эффективных и безопасных препаратов для химиопрофилактики РПЖ остается высокой.
В ФГБУ "НИИ онкологии им. Н.Н.Петрова" Минздравсоцразвития России проведено изучение субстанции Провитама в качестве антиканцерогенного средства на модели канцерогенеза предстательной железы у крыс.
Крысы-самцы Вистар были получены из питомника "Рапполово" РАМН в возрасте 1,5 месяца с начальной массой тела 150–170г. Крысы содержались в условиях автоматически регулируемого искусственного освещения (12 часов свет, 12 часов темнота), получали стандартный комбикорм для содержания лабораторных грызунов ("Лабораторкорм", Москва) и питьевую водопроводную воду без ограничений. Эксперимент начали в возрасте крыс 3 месяца по достижении массы тела 280–310г. У 68 подопытных крыс был индуцирован канцерогенез простаты с использованием собственной модификации комбинированной двухстадийной модели с введением в качестве инициатора канцерогена МНМ и промотора – тестостерона. Модификация модели заключалась в том, что мы использовали не фармакологическую, а хирургическую кастрацию, и не тестостерон пропионат, а пролонгированную форму – СЭТ. Крысам проведена хирургическая кастрация под общей анестезией эфирным наркозом для атрофии простаты. Через 21 день после кастрации крысам введена однократно внутрибрюшинно СЭТ (омнадрен250, " Jelfa ", Польша) в дозе 833 мг/кг массы тела для индукции гиперпролиферации эпителия простаты. Через 3 дня после инъекции СЭТ крысам введена однократно внутривенно (через хвостовую вену) МНМ (Sigma - Aldrich, Co, США) в дозе 50мг/кг. Рандомизация животных (38 крыс в группе "МНМ + СЭТ" и 38 – в группе "МНМ + СЭТ + КХ") проведена через 7 дней после инъекции МНМ, и с этого момента начато воздействие КХ, который ежедневно тщательно замешивали в корм из расчета 2г/кг кормовой смеси. КХ использован производства фирмы "Фитолон-Мед" (Санкт-Петербург). Через 7 дней после инъекции МНМ начат также первый этап промоции: введение СЭТ внутрибрюшинно в дозе 16,7 мг/кг в течение 60 дней с промежутками между введениями 3 дня. После этого СЭТ вводилась внутрибрюшинно в дозе 16,7 мг/кг 1 раз в неделю до конца эксперимента – второй этап промоции. В группе интактного контроля 12 крыс не подвергались никаким воздействиям и наблюдались до конца эксперимента. Крысы содержались в одинаковых условиях, получали корм и водопроводную воду без ограничений. Опыт продолжался в течение 55 недель, плановый забой оставшихся в живых животных производился парами хлороформа на 56-й неделе.
По окончании эксперимента, а также у погибших до этого животных, проводили полную аутопсию. Простату извлекали в виде комплекса дорсолатеральной, вентральных и передних долей (коагуляционных желез) с семенными пузырьками. Для оценки увеличения (доброкачественной гиперплазии) простаты у крыс без видимых крупных опухолевых узлов взвешивали простату и массу тела и рассчитывали простатический индекс как отношение массы дорсолатеральной и вентральных долей простаты в мг/100г массы тела. У всех крыс предстательные железы, независимо от макроскопических изменений, брали для гистологического исследования. Фиксацию тканей и их гистологическую обработку проводили стандартными методами. Готовили серийные срезы всех долей простаты с шагом микротома 500 мкм. Диагноз РПЖ ставился с учетом степени дифференцировки по индексу Глисона. Диагноз ПИН ставился в том случае, если в препаратах обнаруживали распространенные структурные изменения: множественные или хотя бы единичные очаги (скопления) ацинусов с наличием ПИН.
В сравниваемых группах рассчитывали показатели частоты и множественности РПЖ и ПИН. Расчет всех статистических показателей производился по отношению к эффективному числу крыс, то есть дожившим до выявления первого случая ПИН или РПЖ. Результаты экспериментов подвергали статистической обработке на персональном компьютере с помощью программ Excel, Statistica и MSTAT. Для статистического анализа показателей частоты и множественности ПИН и опухолей использовали тест χ 2, точный метод Фишера, критерий t (Стьюдента).
Ни у одного из 12 животных из группы интактного контроля не было выявлено случаев РПЖ или ПИН. В результате воздействия МНМ и СЭТ у крыс развивались множественные РПЖ и ПИН во всех трех отделах простаты: дорсолатеральном, вентральных и передних долях. При этом рак и предраковые изменения развивались на фоне выраженной доброкачественной гиперплазии простаты. Основные макроскопические и микроскопические патологические изменения простаты в сравнении с нормальной картиной представлены на рис. 11.
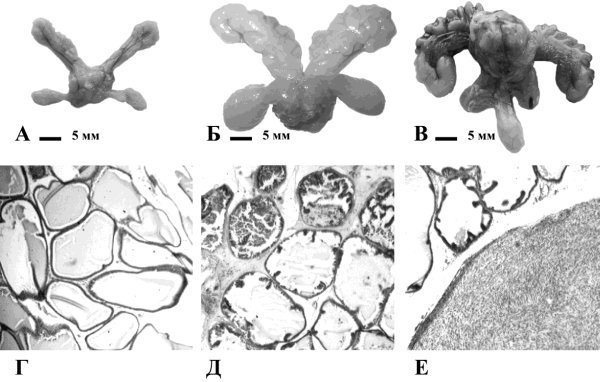
Рис. 11. А – нормальная простата, Б – увеличение всех долей простаты и семенных пузырьков при доброкачественной гиперплазии, В – рак дорсолатерального отдела; Г – нормальная структура дорсолатерального отдела,х 50, Д – очаг ПИН в дорсолатеральном отделе рядом с нормальными ацинусами,х 50, Е – рак дорсолатерального отдела,х 50.
При гистологическом анализе тканей простаты у всех крыс, подвергнутых воздействию МНМ и СЭТ, обнаруживали гистологические проявления доброкачественной гиперплазии железистого, мышечного и железисто-мышечного типа: уменьшение межацинарных пространств, гиперплазия мышечной ткани в септах. По сравнению с контролем, в группе с воздействием КХ проявления доброкачественной гиперплазии простаты были менее выраженными.
Результаты влияния КХ на развитие РПЖ и ПИН представлены в табл.10. У 64,7% крыс из контрольной группы и у 44,1% крыс из группы с воздействием КХ был диагностирован РПЖ, который наиболее часто развивался в дорсолатеральном отделе простаты, реже – в вентральных или передних долях. У одной крысы нередко выявляли РПЖ в нескольких отделах простаты, то есть случаи РПЖ были множественными. В большинстве случаев РПЖ макроскопически выглядели как плотные узлы с бугристой поверхностью. Некоторые крысы с РПЖ имели выраженные симптомы нижних мочевых путей: нарушения или блокирование мочеиспускания, гематурия, растянутый и туго заполненный мочевой пузырь при пальпации брюшной полости. Таких крыс забивали в терминальном состоянии, при аутопсии у них в нижнем отделе брюшной полости и малом тазу обнаруживали крупные опухолевые поражения простаты, иногда опухоль прорастала все отделы простаты и выглядела единым конгломератом, мочевой пузырь был растянут и переполнен, с признаками гематурии. По гистологическому типу все случаи РПЖ были аденокарциномами, в основном, с высоким индексом Глисона (низкой степени дифференцировки). У 32,4% крыс из контрольной группы и у 23,5% крыс из группы с воздействием КХ РПЖ был метастатическим. Наиболее характерными при метастатическом РПЖ были метастазы в висцеральную брюшину, сальник, брыжейку кишечника, диафрагму, различные группы лимфоузлов.
Как видно из табл.10, по сравнению с контролем, КХ снижал частоту РПЖ на 20,6% (p >0,05), множественность РПЖ – на 47,3% (p <0,05), частоту метастатического РПЖ – на 8,9% (p >0,05).
У 76,5% крыс из контрольной группы и у 55,9% крыс из группы с воздействием КХ диагностировали ПИН, которая наиболее часто развивалась в дорсолатеральном отделе простаты, реже – в вентральных или передних долях. У одной крысы нередко выявляли ПИН в нескольких отделах простаты, то есть случаи ПИН были множественными.. В большинстве случаев у крыс с диагнозом ПИН наблюдали распространенные структурные изменения ткани отделов простаты, скопления ацинусов с ПИН в очаги. Как правило, при выявлении распространенной ПИН у крыс в отделах простаты была одновременно ПИН тяжелой и легкой степени. Наиболее часто ПИН была представлена пучкообразной формой, реже – микрососочковой и крибриформной формами. При выявлении единичных очагов ПИН была обычно плоской и пучкообразной. При обширном поражении ткани простаты ПИН наблюдали все ее формы: плоскую, пучкообразную, микрососочковую и крибриформную.
Как видно из табл.10, по сравнению с контролем, КХ снижал частоту ПИН на 20,6% (p >0,05), множественность ПИН – на 42,5% (p <0,05). У крыс из группы с воздействием КХ, которым поставили диагноз ПИН, по сравнению с крысами из контрольной группы поражение ткани простаты ПИН было менее обширным, реже встречались участки более тяжелой формы ПИН: микрососочковой и крибриформной.
Табл. 10. Влияние КХ на частоту и множественность РПЖ и ПИН у крыс, подвергнутых воздействию кастрации, МНМ и СЭТ
|
Показатель |
Группа |
|
|
Контроль: МНМ + СЭТ |
МНМ + СЭТ + КХ |
|
|
Число эффективных крыс в группе |
34 |
34 |
|
Число крыс с РПЖ: абс. (%) |
22 (64,7%) |
15 (44,1%) |
|
Количество выявленных РПЖ |
38 |
20 |
|
Среднее число РПЖ на крысу из группы, M ± m |
1,12 ± 0,1 8 |
0,59 ± 0,12 * |
|
Число крыс с метастатическим РПЖ: абс. (%) |
11 (32,4%) |
8 (23,5%) |
|
Число крыс с ПИН всего: абс. (%) |
26 (76,5%) |
19 (55,9 %) |
|
Количество выявленных отделов простаты с ПИН |
52 |
30 |
|
Среднее число отделов простаты с ПИН на крысу из группы, M ± m |
1,53 ± 0,19 |
0,88 ± 0, 1 6 * |
* Разница с группой "Кастрация МНМ Контроль" статистически достоверна.
Таким образом, КХ предупреждал развитие предрака (ПИН) и РПЖ у крыс с индуцированным канцерогенезом простаты. Наиболее выраженный антиканцерогенный эффект КХ проявил на множественность РПЖ и ПИН. Антиканцерогенные механизмы КХ в отношении ПИН и РПЖ связаны с комплексом содержащихся в препарате веществ, таких как каротиноиды, витамин Е, фитостерины, полипренолы. Помимо общих антиканцерогенных механизмов, о которых сказано выше, данные вещества обладают и специфическими механизмами антиканцерогенного действия на РПЖ.
В эпидемиологических исследованиях повышенное потребление β-каротина и других каротиноидов снижало риск рака различных локализаций, в том числе РПЖ. В проспективном исследовании у 29361 мужчины при сроке наблюдения 8 лет прием β-каротина в виде диетической добавки снижал риск РПЖ у мужчин с изначально низким его потреблением с пищей. Ликопин и лютеин ингибировали пролиферацию клеток андроген-независимого и андроген-зависимого РПЖ крысы в клеточной культуре.
В мета-анализе 12 рандомизированных исследований, в которых участвовало 167025 человек, длительный прием витамина Е в виде диетической добавки достоверно снижал риск РПЖ на 15%. Витамин Е при добавлении в культуру клеток РПЖ человека тормозил рост и подавлял функцию рецептора андрогенов и экспрессию простатспецифического антигена; вызывал апоптоз клеток, активируя разные формы каспаз; ингибировал рост клеток гормоно-независимого РПЖ и подавлял выработку сосудистого эндотелиального фактора роста. При длительном приеме в виде диетической добавки витамин Е снижал уровень андрогенов в сыворотке крови у пожилых мужчин.
В эпидемиологических исследованиях повышенное потребление фитостеринов ассоциировалось со снижением риска РПЖ. В эксперименте β-ситостерин и другие фитостерины тормозили рост и метастазирование РПЖ человека, перевитого иммунодефицитным мышам.
Полипренолы влияют на экспрессию генов в клетках РПЖ. Был проведен микрочиповый анализ генома сублиний клеток РПЖ человека и найден ген, названный простин-1, экспрессия которого ассоциируется с отсутствием инвазии клеток РПЖ; выработка белка данным геном регулируется комплексом, в состав которого входит долихол.
Провитам рекомендуется в качестве негормонального лекарственного средства для первичной и вторичной химиопрофилактики РПЖ. Провитам с целью снижения риска РПЖ рекомендуется принимать мужчинам с факторами риска РПЖ (избыточная калорийность пищи, повышенное потребление жира, мяса, животных продуктов, недостаточное потребление растительных продуктов, овощей и фруктов; ожирение, метаболический синдром; гиподинамия; подвергавшиеся воздействию химических канцерогенов и ионизирующей радиации), пациентам с ПИН и микроочаговым латентным (индолентным) РПЖ.
5. Изучение Провитама в паразитологии
По данным ВОЗ, из 50 млн человек, ежегодно умирающих в мире, более чем у 16 млн причиной являются паразитарные и инфекционные заболевания. Для ряда хронических, в том числе некоторых онкологических заболеваний, паразиты и инфекции могут играть этиопатогенетическую роль. Особую озабоченность вызывает повсеместное и быстрое распространение описторхоза из-за употребления в пищу сырой, недостаточно термически обработанной, малосоленой рыбы. Эта глистная инвазия приводит к развитию панкреатита, язвы желудка и двенадцатиперстной кишки, способствует развитию холангиокарциномы и рака поджелудочной железы, желчнокаменной болезни.
Арсенал противоописторхозных средств в России ограничен одним синтетическим препаратом – бильтрицидом (празиквантель). Препарат достаточно эффективен, но обладает широким спектром побочных реакций, имеет ряд противопоказаний, особенно в детской практике. Прием бильтрицида вызывает тошноту, рвоту, кожный зуд, сыпь, наблюдается поражение печени, цитогенетические нарушения и др. Из-за высокой токсичности бильтрицид можно повторно применять не ранее чем через год, но часто из-за побочных реакций повторные курсы невозможны.
В комплексной терапии описторхоза и для его профилактики возможно использование БАД противопаразитарного действия. Например, БАД "Экорсол" и "Популин" производства ООО "Биолит" (Россия, г.Томск). В состав входят экстракты осиновой коры и солянки холмовой для комплексного лечения описторхоза. Их сочетание в определенной степени эффективно, а главное – безопасно для человека. Однако курсы приема этих БАД длительные, а эффективность недостаточна для лечения описторхоза. Эти БАД получают с использованием экстракта осиновой коры, который содержит горечи, фенолгликозиды, производные салигенина (салицин, популин, тремулоидин, тремулацином, саликортином), дубильные вещества, органические кислоты (бензойная, яблочная, аскорбиновая), эфирные масла. Состав обеспечивает желчегонный, противовоспалительный, бактерицидный, спазмолитический эффекты, способствует улучшению аппетита.
В Сибирском государственном медицинском университете (г.Томск) на кафедре фармацевтической химии были проведены испытания по применению КХ в качестве средства для профилактики и лечения описторхоза. В эксперименте использовали, кроме контрольной группы, бельтрицид, экстракт осиновой коры и КХ.
Эффективность препаратов определялась по коэффициенту ИЭ, который является критерием противоописторхозной активности. Была создана модель хронического описторхоза, рекомендованная Фармакологическим комитетом. В качестве экспериментальных животных использовали золотистых хомяков обоего пола массой 40–45 г, которых содержали в условиях вивария при естественном световом режиме на стандартной диете при свободном доступе к воде и пище.
Метацеркарии описторхов выделяли из рыб карповых пород (преимущественно, елец, плотва). Из зараженной рыбы, методом переваривания в искусственном желудочном соке, выделяли метацекарии описторхов. Для этого мышечную ткань рыбы с кожей и подкожной клетчаткой дважды пропускали через мясорубку. Навеску фарша помещали в сосуд с плоским дном и заливали искусственным желудочным соком, состоящим из 11мл концентрированной соляной кислоты, 7г пепсина, 9г хлорида натрия и 1л очищенной воды. На 100г фарша использовали 1л искусственного желудочного сока. После этого сосуд помещали на 18–20 ч в термостат про 37˚С. Затем смесь вынимали из термостата, перемешивали и оставляли на 10–15 мин. Метацекарии при этом опускались на дно, образуя осадок. Надсадочную жидкость сливали и пептолизат протирали через два слоя марли, смывая физиологическим раствором в высокую мензурку. Через указанное время лишнюю жидкость убирали, затем вновь добавляли физиологический раствор, и смесь вновь оставляли на 10–15 мин. Процесс повторяли 4–6раз.
Далее осадок помещали в чашку Петри, которую вращали попеременно по- и против часовой стрелки таким образом, чтобы в ее центре собирались метацекарии. Затем под микроскопом их отбирали микропипеткой и в количестве по 50экземпляров в 0,5мл изотонического раствора натрия хлорида вводили внутрижелудочно экспериментальным животным. Клинические проявления заболевания развивались через 30суток после заражения. У животных наблюдалось облысение волосяного покрова, отмечалась адинамия и агрессивность.
Для более точного подтверждения заболевания проводили контрольное вскрытие нескольких животных. В органах гепатобилиарной системы (печень, желчный пузырь и поджелудочная железа) хомяков было выявлено значительное количество марит описторхов, в связи с чем констатировали факт развития описторхоза и проводили лечение исследуемыми препаратами с последующей оценкой их эффективности.
Подопытные животные были распределены на 5 групп по 10 животных в каждой: группа1 (интактная) – здоровые животные; группа2 (контрольная 1) – животные с описторхозом; группа3 (контрольная 2) – животные с описторхозом получавшие препарат сравнении – билтрицид. Группы 4–5 (экспериментальные) – животные с описторхозом, получавшие экстракт осиновой коры и КХ. Исследуемые препараты вводили внутрижелудочно металлическим зондом.
Латентный период после окончания курсового введения исследуемых препаратов составил 14 дней, в течение которых происходит естественное выведение марит описторхов, утративших жизнеспособность в результате лечения. Затем животных забивали в герметической камере с углекислым газом и производили их вскрытие и анатомическое изучение. В табл.11 даны схемы введения препаратов, дозы и полученные результаты. Противоописторхозную активность КХ (группа 5) определяли в сравнении с бильтрицидом (группа3), группой 4, получавшей экстракт осиновой коры параллельно с группой интактных животных (группа1), и контрольной группой животных с описторхозом (группа2). Дозы и схемы введения препаратов выбирали в соответствии с их химическим составом и возможностью применения без появления побочных эффектов (гибели животных). Полученные результаты подвергнуты математической обработке методом дескриптивной статистики по критерию Стьюдента с использованием пакета программного обеспечения Statistica 6.0.
Табл.11. Схемы введения и значения ИЭ* исследуемых образцов
|
Группы животных |
Доза, схема введения |
ИЭ, % |
ИЭ в сравнении с бильтрицидом |
|
Группа 1 (n = 10): интактные животные |
|||
|
Группа 2 (контрольная1, n = 10): животные с описторхозом |
|||
|
Группа3 (контрольная2, n = 10): препарат сравнения бильтрицид |
0,02 г/кг двукратно в течение одного дня |
65,6 ± 6,2 |
|
|
Экспериментальная группа4 (n = 10): экстракт осиновой коры |
2,0 г/кг три раза в день в течение трех дней |
12,7 ± 4,4 |
19,3 |
|
Экспериментальная группа5 (n = 10): КХ |
0,35 г/кг два раза в день в течение трех дней |
17,4 ± 5,6 |
26,5 |
* ИЭ рассчитывали по формуле: ИЭ = К – О/К × 100%, где К – среднее число марит описторхов в группе2 (контрольная 1); О – среднее число марит описторхов в экспериментальной группе
Результаты эксперимента, представленные в табл. 11, позволяют оценить эффективность КХ в сравнении с бильтрицидом и экстрактом осиновой коры. Полученные результаты свидетельствуют о том, что все испытанные препараты в разной степени обладают противоописторхозной активностью. Выявлено, что экстракт осиновой коры проявляет противоописторхозную активность. В настоящее время экстракт осиновой коры применяется для борьбы с гельминтами в качестве профилактического средства и в комплексном лечении. Эффективность КХ оказалась выше, чем у экстракта осиновой коры, на 7,2%. Следовательно, Провитам также целесообразно использовать для этих целей, а также в качестве вспомогательного средства для повышения эффективности медикаментозной терапии. Пересчет доз с хомяков на человека позволяет рекомендовать для борьбы с описторхозом принимать 2,95г КХ на один прием.
Заключение
Провитам – поливитаминный комплекс – адаптоген широкого спектра действия, содержащий биологически активные вещества из хвои сосны и ели, сохраненные благодаря уникальной российской технологии. Провитам может применяться в качестве антиоксиданта, кардиопротектора, онкопротектора, противопаразитарного средства для профилактики и в схемах комплексного лечения.
Провитам рекомендуется:
– для восполнения дефицита в питании фитостеринов, витамина Е и каротиноидов;
– для профилактики и в комплексном лечении сердечно-сосудистых заболеваний для нормализации уровня холестерина, снижения содержания липопротеидов низкой плотности и коэффициента атерогенности;
– для снижения риска рака легкого, рака простаты и других онкологических заболеваний;
– для усиления иммунной защиты, в качестве адаптогена, при астеническом синдроме;
– для профилактики и в комплексном лечении гельминтозов.
Дозировка: взрослые и дети старше 14 лет по 1–3 таблетки 2 раза в день во время еды. Курс приема 1–3 месяца. При необходимости прием можно повторять. В комплексном лечении – до 6 таблеток в день, курс приема 3–6 месяцев. С целью профилактики сердечно-сосудистых и онкологических заболеваний Провитам рекомендуется принимать по 1 таблетке 2–3 раза в день в течение длительного времени или курсами по 3–6 месяцев.
Противопоказания: индивидуальная непереносимость компонентов продукта.
Хранить в сухом защищенном от света месте при температуре не выше 25°С.
Свидетельство о государственной регистрации № 77.99.11.3.У.2354.4.10. ТУ 9197-002-85520899-10.
Провитам защищен патентом России №21885, 2002 г. и товарным знаком (свидетельство №201817, 2001 г.). Провитам награжден знаком "Зеленый крест" Национальной организации Международного Зеленого Креста в России "За вклад в улучшение здоровья людей и выпуск полезной продукции".
Литература
1. Аполихин О.И., Сивков А.В., Бешлиев Д.А. и др. Анализ уронефрологической заболеваемости в Российской Федерации по данным официальной статистики// Эксперим. и клин. урол. – 2010. – №1. – С.4–11.
2. Беспалов В.Г. Питание и рак. Диетическая профилактика онкологических заболеваний. – М., 2008. – 176с.
3. Беспалов В.Г., Муразов Я.Г., Панченко А.В. Химиопрофилактика рака предстательной железы: обзор клинических и доклинических данных// Экспер. и клин. урол. – 2011. – №4. – С.80–85.
4. Беспалов В.Г., Некрасова В.Б. Лечебно-профилактические средства из биомассы дерева. – СПб.: Изд-во Политехн. ун-та, 2007. – 192с.
5. Болезни предстательной железы/ Под ред. Ю.Г.Аляева. – М.: ГЭОТАР-Медиа, 2009. – 240с.
6. Болобан Л.Г. Масло льняное – наше здоровье сегодня, завтра и всегда. – Краснодар-Москва-Тверь, 1998. – 34с.
7. Григорьева Н.Я., Моисеенков А.М. Физиологическая активность полиизопреноидов // Хим.-фарм. журнал. – 1989. – №2. – С.145–155.
8. Завойкин В.Д., Зеля О.П., МихайловМ.М., БрагинВ.В. Тактика широкого применения празиквантеля в комплексе мер борьбы с описторхозом. 3. Общие подходы к амбулаторному лечению больных описторхозом в очагах// Мед. паразитол. и паразитар. болезни. – 2001. – №2. – С.13–17
9. Некрасова В.Б., Курныгина В.Т., Никитина Т.В. Биологически активные вещества хвои сосны и ели и их применение в медицине// Изучение и применение лечебно-профилактических препаратов на основе природных биологически активных веществ / Под ред. В.Г.Беспалова и В.Б.Некрасовой. – СПб.: Эскулап, 2000. – С.92–96.
10. Паразитарная инфекция, дисбаланс микроэлементов – болезни деградации и невежества. – М.: "ОПТИСАЛТ-Иридо Скрин", 2010. – 33с.
11. Патент №2137479 (РФ). Иммуномодулирующее средство/ В.И.Рощин. – Заявл. 27.08.97 №97114477; Опубл. в Б.И., 1999. №26.
12. ПлавинскийС.Л., ПлавинскаяС.И. Роль антиоксидантов в лечении и профилактике заболеваний человека// Рос. семейный врач. – 2004. – Т.8, №2. – С.65–75.
13. Рекомендуемые уровни потребления пищевых и биологически активных веществ: методические рекомендации МР 2.3.1.1915-04/ В.А.Тутельян, А.К.Батурин, А.В.Васильев идр. – М.: Государственное санитарно-эпидемиологическое нормирование Российской Федерации, 2004. – 36с.
14. Рощин В.И. Состав, строение и биологическая активность терпеноидов из древесной зелени хвойных растений: Автореф. дис … д-ра хим. наук. – СПб., 1995. – 35с.
15. Рощин В.И. Химический состав липидной фракции хвои сосны и ели // Изучение и применение лечебно-профилактических препаратов на основе природных биологически активных веществ / Под ред. В.Г. Беспалова и В.Б. Некрасовой.- СПб.: Эскулап, 2000. – С. 114–116.
16. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / Под ред. Р.У.Хабриева. – М.: Медицина, 2005. – С.615–636.
17. Солодкий Ф.Т. Витамины из лесного сырья. – М.-Л.: Гослесотехническое изд-во, 1947. – 49с.
18. Чернышева Н.К., Агранат А.Л., Солодкий Ф.Т. Выделение и изучение неомыляемой фракции смолистых веществ хвои// Труды Ленинградской лесотехнической академии им.С.М.Кирова №119. – Л.: 1969. – С.47–54.
19. Шишкина Л.Н., Сафатов А.С., СергеевА.Н. идр. Механизмы резистентности мышей к вирусу гриппа A / AICHI /2/68 после профилактической инъекции полипренолов // Вопр. вирусол. – 2001. – Т.46, №3. – С.34–38.
20. Ягодин В.И. Основы химии и технологии переработки древесной зелени. – Л.: ЛГУ. – 1981. – С.113–118.
21. Alkhenizan A., Hafez K. The role of vitamin E in the prevention of cancer: a meta-analysis of randomized controlled trials// Ann. Saudi Med. – 2007. – Vol.27. – P.409–414.
Epstein J.I. Precursor lesions to prostatic adenocarcinoma// Virchows Arch. – 2009. – Vol.454. – P.1–16.
22. Awad A.B., Fink C.S. Phytosterols as anticancer dietary components: evidence and mechanism of action// J. Nutr. – 2000. – Vol.130. – Р.2127–2130.
23. AwadA.B., FinkC.S., WilliamsH., KimU. In vitro and in vivo (SCID mice) effects of phytosterols on the growth and dissemination of human prostate cancer PC-3 cells// Eur.J. Cancer Prev. - 2001. - Vol.10. - P.507 - 513.
24. BaronJ.A., Cole B.F., MottL. Neoplastic and antineoplastic effects of beta-carotene on colorectal adenoma recurrence: results of a randomized trial// J. Natl. Cancer Inst. – 2003. – Vol.95. – P.717–722.
25. BendichA. From 1989 to 2001: what have we learned about the "biological actions of beta-carotene"?// J. Nutr. – 2004. – Vol.134. – P.225–230.
26. Bergamini E., Bizzarri R., CavalliniG. etal. Ageing and oxidative stress: a role for dolichol in the antioxidant machinery of cell membranes?// J. Alzheimers Dis. – 2004. – Vol.6. – P.129–135.
27. Bhilwade H.N., Tatewaki N., Nishida H., Konishi T. Squalene as novel food factor// Curr. Pharm. Biotechnol. – 2010. – Vol.11. – P.875 –8 80.
28. BhuvaneswariV., NaginiS. Lycopene: a review of its potential as an anticancer agent// Curr. Med. Chem. Anticancer Agents. – 2005. – Vol.5. – P.627–635.
29. Blot W.J., Li J.Y., TaylorP.R. etal. Nutrition intervention trials in Linxian, China: supplementation with specific vitamin/mineral combinations, cancer incidence, and disease-specific mortality in the general population// J. Natl. Cancer Inst. – 1993. – Vol.85. – P.1483–1492.
30. Brigelius-Flohe R., Kelly F.J., SalonenJ.T. The European perspective on vitaminE: current knowledge and future research// Am. J. Clin. Nutr. – 2002. – Vol.76. – P.703 – 716.
31. De Stefani E., Deneo-Pellegrini H., MendilaharsuM., RoncoA. Essential fatty acids and breast cancer: a case-control study in Uruguay // Int. J. Cancer. – 1998. – Vol.76. – Р.491 – 494.
32. Eggens I., Elmberger P.G. Studies on the polyisoprenoid composition in hepatocellular carcinomas and its correlation with their differentiation // APMIS. – 1990. – Vol.98. – Р.535 – 542.
33. Elliott R. Mechanisms of genomic and non-genomic actions of carotenoids// Biochim. Biophys. Acta. – 2005. – Vol.1740. – P.147–154.
34. EngelhartM.J., GeerlingsM.I., RuitenbergA. etal. Dietary intake of antioxidants and risk of Alzheimer disease// JAMA. – 2002. – Vol.287. – P. 3223 –322 9.
35. Escrich E., Solanas M., Moral R., Escrich R. Modulatory effects and molecular mechanisms of olive oil and other dietary lipids in breast cancer// Curr. Pharm. Des. – 2011. – Vol.17. – P.813–830.
36. EtminanM., GillS.S., SamiiA. Intake of vitamin E, vitamin C, and carotenoids and the risk of Parkinson’s disease: a meta-analysis// Lancet Neurol. – 2005. – Vol.4. – P.362–365.
37. Falcone T.D., Kim S.S., Cortazzo M.H. Vitamin K: fracture prevention and beyond// PMR. – 2011. – Vol.3(6Suppl.1). – P.82–87.
38. Goto T., Takahashi N., Kato S. et al. Phytol directly activates peroxisome proliferator-activated receptor alpha (PPARalpha) and regulates gene expression involved in lipid metabolism in PPARalpha-expressing HepG2 hepatocytes// Biochem. Biophys. Res. Commun. – 2005. – Vol.337. – P.440 –44 5.
39. Gunasekera R.S., Sewgobind K. Desai S. et al. Lycopene and lutein inhibit proliferation in rat prostate carcinoma cells// Nutr Cancer. – 2007. – Vol.58. – P.171–177.
40. Gupta A.K., Savopoulos C.G., Ahuja J., Hatzitolios A.I. Role of phytosterols in lipid-lowering: current perspectives// QJM. – 2011. – Vol.104. – P.301–308.
41. Hartman T.J., Dorgan J.F., Woodson K. etal. Effects of long-term alpha-tocopherol supplementation on serum hormones in older men// Prostate. – 2001. – Vol.46. – P.33–38.
42. Heinonen O.P., Albanes D., VirtamoJ. etal. Prostate cancer and supplementation with alpha-tocopherol and beta-carotene: incidence and mortality in a controlled trial// J. Natl. Cancer Inst. – 1998. – Vol.90. – P.440–446.
43. Hitomi M., Yokoyama F., Kita Y. et al. Antitumor effects of vitamins K1, K2 and K3 on hepatocellular carcinoma in vitro and in vivo// Int. J. Oncol. – 2005. – Vol.26. – P. 713 – 720.
44. IARC Working Group on the Evaluation of Cancer Preventive Agents. Carotenoids. – IARC Handbooks of Cancer Prevention. – Vol.2. – France: International Agency for Research on Cancer, 1998. – 326ps.
45. Jialal I., Devaraj S. Scientific evidence to support a vitamin E and heart disease health claim: research needs// J. Nutr. – 2005. – Vol.135. – P.348 – 53.
46. KirshV.A., HayesR.B., MayneS.T. et al. Supplemental and dietary vitamin E, beta-carotene, and vitamin C intakes and prostate cancer risk// J. Natl. Cancer Inst. – 2006. – Vol.98. – P.245–254.
47. Knekt P. Role of vitamin E in the prophylaxis of cancer// Ann. Med. – 1991. – Vol.23. – P.3 – 12.
48. Komiya T., Kyohkon M., OhwakiS. etal. Phytol induces programmed cell death in human lymphoid leukemia Molt 4B cells // Int. J. Mol. Med. – 1999. – Vol.4. – Р.377 – 380.
49. KontushK., SchekatolinaS. Vitamin E in neurodegenerative disorders: Alzheimer´s disease// Ann. N.Y. Acad. Sci. – 2004. – Vol.1031. – P.249–262.
50. Lamb D.J., Zhang L. Challenges in prostate cancer research: animal models for nutritional studies of chemoprevention and disease progression// J. Nutr. – 2005. – Vol.135 (12Suppl.). – P.3009S–3015S.
51. Manos E.J., Kim M.L., KassisJ. etal. Dolichol-phosphate-mannose-3 (DPM3)/prostin-1 is a novel phospholipase C-gamma regulated gene negatively associated with prostate tumor invasion// Oncogene. – 2001. – Vol.20. – P.2781–2790.
52. Newcomer L.M., King I.B., WicklundK.G., StanfordJ.L. The association of fatty acids with prostate cancer risk // Prostate. – 2001. – Vol.47. – Р.262 – 268.
53. Parkin D.M., Bray F., Ferlay J., Pisani P. Global cancer statistics, 2002// CA Cancer J. Clin. – 2005. – Vol.55. – P.74–108.
54. Ondrey F. Peroxisome proliferator-activated receptor gamma pathway targeting in carcinogenesis: implications for chemoprevention// Clin. Cancer Res. – 2009. – Vol.15. – P.2 – 8.
55. Ostlund R.E. Phytosterols in human nutrition// Annu. Rev. Nutr. – 2002. – Vol.22. – P.533–549.
56. Rao G.N., Ney E., HerbertR.A. Effect of melatonin and linolenic acid on mammary cancer in transgenic mice with c-neu breast cancer oncogene // Breast Cancer Res. Treat. – 2000. – Vol.64. – Р.287–296.
57. Rezanka T., Votruba J. Chromatography of long chain alcohols (polyprenols) from animal and plant sources// J. Chromatogr. A. – 2001. – Vol.936. – P.95–110.
58. Ribaya-MercadoJ.D., BlumbergJ.B. Lutein and zeaxanthin and their potential roles in disease prevention// J.Am. Coll. Nutr. – 2004. – Vol.23 (6Suppl.). – P.567S–587S.
59. Rudkowska I. Plant sterols and stanols for healthy ageing// Maturitas. – 2010. – Vol.66. – P.158–162.
60. Suzuki T., Ezure T., IshidaM. Synergistic effects of some pairs of antioxidants and related agents on mouse leukaemia L5178Y cell growth in-vitro // J. Pharm. Pharmacol. – 1998. – Vol.50. – Р.1173–1177.
61. Tucker J.M., Townsend D.M. Alpha-tocopherol: roles in prevention and therapy of human disease// Biomed. Pharmacother. – 2005. – Vol.59. – P.380–387.
62. WhiteheadA.J., MaresJ.A., DanisR.P. Macular pigment: a review of current knowledge// Arch. Ophthalmol. – 2006. – Vol.124. – P.1038–1045.
63. Woyengo T.A., Ramprasath V.R., Jones P.J. Anticancer effects of phytosterols// Eur. J. Clin. Nutr. – 2009. – Vol.63. – P.813–820.
64. Yamada K., Tsukidate K., TakiT. etal. Time course of dolichol and dolichyl phosphate during chemical carcinogenesis in rat liver // Biochim. Biophys. Acta. – 1987. – Vol.921. – Р.567–574.
65. Yasugi E., Yokoyama Y., SeyamaY. etal. Dolichyl phosphate, a potent inducer of apoptosis in rat glioma C6 cells // Biochem. Biophys. Res. Commun. – 1995. – Vol.216. – P.848–853.
66. Yokoyama Y., Okubo T., OzawaS. etal. CPP32 activation during dolichyl phosphate-induced apoptosis in U937 leukemia cells // FEBS Lett. – 1997. – Vol.412. – P.153–156.
67. Yu A., Somasundar P., Balsubramaniam A. etal. Vitamin E and the Y4 agonist BA-129 decrease prostate cancer growth and production of vascular endothelial growth factor// J. Surg. Res. – 2002. – Vol.105. – P.65–68.
68. ZaridzeD., Evstifeeva T., BoyleP. Chemoprevention of oral leukoplakia and chronic esophagitis in an area of high incidence of oral and esophageal cancer// Ann. Epidemiol. – 1993. – Vol.3. – P.225–234.
69. Zhang Y., Ni J., Messing E.M. et al. Vitamin E succinate inhibits the function of androgen receptor and the expression of prostate-specific antigen in prostate cancer cells// Proc. Natl. Acad. Sci. USA. – 2002. – Vol.99. – P.7408–7413.
70. Zu K., Ip C. Synergy between selenium and vitamin E in apoptosis induction is associated with activation of distinctive initiator caspases in human prostate cancer cells// Cancer Res. – 2003. – Vol.63. – P.6988–6995.
Препарат ПРОВИТАМ в каталоге >>
Скачать брошюру в PDF-формате>>
