5. Применение «Фитолона» в комплексном лечении туберкулеза и других инфекционных заболеваний
Упоминаемые в брошюре препараты: «Лесмин», «Фитолон», «Альгинат Кальция»
При значительных стрессовых нагрузках происходит разбалансирование гормональных и медиаторных систем регуляции и, как следствие, токсическое повреждение сосудов, нарушение микроциркуляции, чрезмерная активизация реакций перекисного окисления липидов, повреждение клеточных мембран, иммунодепрессия. Фитолон, как адаптоген, подобно препаратам этой группы, обладает несомненным антистрессорным действием, повышая функциональную способность систем адаптации организма.
Нарушение сбалансированности в организме человека реакций перекисного окисления липидов и антиоксидантной защиты приводит к образованию свободных радикалов и повреждению клеточных мембран, а также наследственного аппарата клетки [22]. Адаптоген «Фитолон» тормозит образование свободных радикалов или быстро их окисляет, препятствуя процессам клеточного повреждения [22].
Антиоксидантную активность «Фитолона» определяют содержащиеся в нем МПХ. В основе химической структуры МПХ лежит медный комплекс порфиринового цикла, в котором медь связана с азотом четырех пиррольных групп, соединенных между собой боковыми углеродными мостиками. Многочисленные исследования, выполненные на животных с воспроизведенными патологическими процессами, показали, что хлорофиллсодержащие препараты стимулируют гемопоэз, заживление ран и язв, усиливают обмен веществ, обладают антимутагенными и антиканцерогенными свойствами, оказывают противовоспалительное, бактерицидное действия, потенцируют действие антибиотиков, снижают повышенный уровень холестерина и липидов в крови. Ингибируют активность протеаз, аминопептидаз, декарбоксилазы, трипсина, тромбина, катепсина, гиалуронидазы.
Эффекты действия хлорофиллов более выражены при патологическом состоянии организма, чем при физиологической норме. Структурное сходство хлорофилла с гемом гемоглобина явилось основанием для изучения гемопоэтических свойств этого пигмента. В качестве возможных механизмов гемостимулирующей активности «Фитолона» следует учитывать два момента: во-первых, комбинация липидного комплекса и ионов меди, связанных в порфириновом кольце способствует абсорбции железа из желудочно-кишечного тракта, восстанавливая тем самым процессы кроветворения и синтез некоторых ферментов; во-вторых, «Фитолон» приводит к нормализации баланса между реакциями перекисного окисления липидов и антиоксидантной защитой.
Медь участвует в работе ферментов (будучи составной частью более 20 белков и ферментов), обеспечивающих антиоксидантную защиту, она необходима для нормального протекания процессов кроветворения, утилизации железа, поддержания эластичности сосудов [4]. Медь является компонентом эластина - внешнего покрытия нервных волокон и одного из внутренних слоев стенок кровеносных сосудов, коллагена - основного структурного белка организма. Она также играет важную роль в продуцировании пигментов кожных покровов. Вместе с витамином С медь повышает сопротивляемость организма к инфекционным заболеваниям, да и сама уничтожает вредные бактерии. Установлена связь меди с функцией щитовидной железы. Так, при тиреотоксикозе содержание меди в крови повышается. Потребность в меди определена в количестве 0,035 мг/кг массы тела (для взрослого человека это более 2 мг/сут.) [23]. Дефицит меди может развиться при молочной диете и употреблении в пищу рафинированных продуктов. Избыток меди возможен лишь при случайном отравлении ее солями. Однако в «Фитолоне», как и в его субстанции - МПХ, свободные ионы меди и неорганические соли меди отсутствуют. В организм медь должна поступать только в связанном виде, такая задача решается в производстве МПХ из пищевых водорослей, а также из хвои сосны и ели. Форма выпуска - таблетки и сироп, спиртовые капли, масляный раствор, что делает возможным применение БАД «Фитолон» различными возрастными группами населения [24].
В НИИ фтизиопульмонологии при изыскании способов повышения эффективности лечения туберкулеза одним из разрабатываемых подходов к решению этой проблемы является использование адаптогенов природного происхождения, поскольку их преимуществами являются низкая токсичность, возможность длительного применения без существенных побочных эффектов и экологически безопасная технология изготовления [6, 7]. Было показано, что использование «Фитолона» на фоне изониазида и рифампицина сопровождалось существенным ускорением регрессии экспериментального инфекционного процесса, о чем свидетельствовали: улучшение общего состояния животных, выраженный прирост массы их тела, снижение интенсивности бактериовыделения, а также индексов поражения легких, что морфологически выражалось значительным сокращением распространенности специфического поражения легочной ткани, исчезновением альтеративного компонента воспаления.Отмечено повышение функциональной активности этиотропной терапии экспериментального туберкулеза, что позволило добиться роста результативности лечения в среднем в 1,7- 2,0 раза (табл. 9-12).
Показано, что «Фитолон» угнетает жизнеспособность микобактерий туберкулеза, проявляет синергизм с фармпрепаратами, ускоряет регрессию патологического процесса за счет экссудативного компонента воспаления, и благоприятно влияет на иммунный статус [6, 7].
Полученные экспериментальные данные свидетельствуют о перспективности использования «Фитолона» в комплексной терапии туберкулеза для повышения ее эффективности. Наиболее целесообразно назначать «Фитолон» во фтизиатрии при замедленной инволюции специфического процесса, наличия интоксикационного синдрома, гепатотоксических реакциях на этиотропные средства. Применять - длительными курсами, не менее 6-8 недель.
Учитывая широкий благоприятный для фтизиатрии спектр действия, «Фитолон» рекомендован ВНИИ фтизиопульмонологии к применению в клинике для лечения больных при различных формах туберкулеза легких для усиления результативности лечения, особенно при прогрессирующих распространенных деструктивных процессах с бактериовыделением и замедленной инволяцией [6]. Сотрудниками СПб.НИИФП (А.Е. Александрова, Т.И. Виноградова, С.В. Ерешко) на основании экспериментальных исследований была разработана инструкция от 31.08.1995 г. «Использование природного адаптогена «Фитолон» в комплексной терапии туберкулеза для повышения ее эффективности».
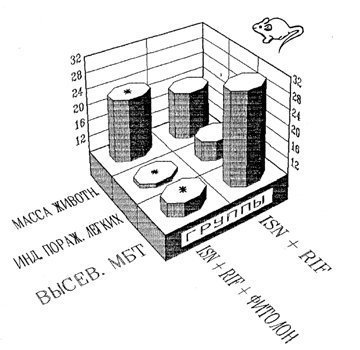
Рис. 3. Влияние «Фитолона» на эффективность этиотропной терапии туберкулеза
Таблица 9 Влияние «Фитолона» нарост микобактерий туберкулеза (опыты in vitro)
|
Концентрация «Фитолона» в среде |
Количество колониеобразующих единиц микобактерий |
|
0 |
300 |
|
1:50 |
100 |
|
1:100 |
300 |
|
1:200 |
300 |
Таблица 10 Влияние « Фитолона» на туберкулостатический эффект изониазида (опыты in vitro)
Количество колониеобразующих единиц микобактерий
|
Концентрация «Фитолона» в среде инкубации |
Концентрация изониазида в среде инкубации, мкг/мл |
|||
|
0 |
0 |
0,025 |
0,05 |
0,1 |
|
1:50 |
100 |
100 |
0 |
0 |
|
1:100 |
300 |
300 |
100 |
0 |
|
1:200 |
300 |
300 |
100 |
0 |
|
0 |
300 |
200 |
100 |
0 |
Таблица 11 Влияние «Фитолона» на эффективность изониазида при экспериментальном туберкулезе мышей
|
№ гр. п/п |
Условия опыта |
Количество животных в группе |
Г ибель животных, % к исх. |
Масса тела животных на конец эксперимента |
Коэффициент массы легких, уел. ед. |
Индекс поражения легких, уел. ед. |
|
1 |
Контроль заражения |
20 |
100 |
— |
5,15 (4,23-6,26) |
4,95 (4,75-5,0) |
|
2 |
Фитолон 1:50, внутрь 0,2 мл |
15 |
100 |
— |
4,61 (2,67-6,55) |
4,42 (3,0-5,0) |
|
3 |
Изониазид, 10 мг/кг, подкожно |
15 |
13,3 |
19,46 (15,5-24,5) |
2,80 (1,9-3,74) n = 13 |
2,67 (2,0-3,35) |
|
4 |
Изониазид + Фитолон |
15 |
0 |
22,49 (18,3-26,25) |
2,36 (1,23-3,11) |
2,37 (1,5-3,0) |
На санаторном этапе лечения туберкулеза у детей и подростков, когда большинство из них длительно получали химиопрепараты и возможности как этиотропной, так и патогенетической терапии во многом исчерпаны, особенно оправданно применение естественных адаптогенов, обладающих поливалентным действием на весь организм. К разряду таких адаптогенов относится «Фитолон» в различных товарных формах (капли, таблетки, сироп, капсулы) и другие адаптогены производства НПФ «Фитолон», «Лесмин» - хвойные таблетки, «Альгиклам» и «Йод-Элам».
В СПб Государственной педиатрической медицинской академии в течение многих лет изучали эффективность БАД производства НПФ «Фитолон» в комплексном лечении туберкулеза. Антиоксидантный, противовоспалительный, иммуностимулирующий эффекты этих БАД изучены и подтверждены на многих заболеваниях, в том числе при туберкулезе [25]. Клинической базой для проведенных исследований послужили детско-подростковые туберкулезные санатории «Дружба» и «Пушкинский» [25].
Таблица 12 Влияние «Фитолона» на эффективность этиотропных средств и иммунный статус мышей при экспериментальном туберкулезе
|
№ гр. п/п |
Условия опыта |
Масса тела животных на конец эксперимента |
Высеваем ость МВТ из селезенки (количество КОЕ) |
Коэффициент массы легких, уел. ед. |
Индекс поражения легких, уел. ед. |
Коэффициент массы печени, уел. ед. |
Активность 5-нуклеотидазы, Уел. ед. |
|
1 |
Интактные |
- |
- |
- |
- |
5,42(5,02-6,12) |
2,58(1,62-3,4) |
|
2 |
Контроль заражения |
- |
290,0(290, 0-290,0) |
5,15 (4,23-6,260 |
4,95 (4,75-5,0) |
10,42 (8,63-12,75) |
- |
|
3 |
Изониазид, 10 мг/кг, подкожно + Рифампицин 10 мг/кг внутрь |
19,93 (15,85-25,6) |
30,8 (8,0-50,0) |
1,26 (0,8-2,4) |
1,29(0,75-2,5) |
6,33 (4,69-7,35) |
5,23(2,09-11,1) |
|
4 |
Изониазид + Рифампицин + Фитолон 1:50, внутрь 0,2 мл |
23,46 (19,6-29,4) |
11,7 (1,5-24,5) |
1,01(0,6-1,91) n=19 |
0,90 (0,5-1,75) |
5,46 (4,05-6,74) |
4,05 (1,03-5,73) |
Материалом исследования явились результаты применения «Фитолона» (таблетки) в лечении 23 подростков 14-18 лет. «Фитолон» назначали по 1 таблетке 3 раза в день в течение 2 месяцев на фоне противотуберкулезной химиотерапии. Контрольная группа - 20 человек, не получавших «Фитолон». Из изучаемых подростков основной группы туберкулезный контакт (семейный, родственный) был установлен у 8 человек (34,8%), в контрольной группе - у 10 (50%). Неудовлетворительные материально-бытовые условия имели место у 4 (17,4%) подростков основной группы и у 4 (20,0%) контрольной. Основная и контрольная группы больных были близки по составу клинических форм (табл. 13). При выявлении заболевания у больных основной группы в 12 случаях (52,2%) отмечалась фаза распада, у 7 больных - фаза инфильтрации без бактериовыделения. Среди больных контрольной группы при выявлении процесса распад зарегистрирован у 6 подростков (30,0%), у 2 из них - МВТ (+). В остальных случаях - фаза инфильтрации, МВТ (-).
До назначения «Фитолона» больные получали этиопатогенетическую терапию различной продолжительности, сроки которой не могли не сказаться на дальнейшей эффективности лечения. В связи с этим больные были разделены на две группы в зависимости от сроков применения «Фитолона»: 1-я группа со сроком предшествующей XT от 1 до 6 месяцев и 2-я группа - со сроком более 6 месяцев (табл. 10). Большинство больных (60%) в обеих группах к моменту назначения «Фитолона» имели срок XT более 6 месяцев, что отражает специфику санаторного этапа лечения. У больных на этих сроках лечения отмечалась замедленная динамика процесса с преобладанием продуктивной реакции и фиброзообразования. У части этих подростков отмечался торпидный, волнообразный характер заболевания с обострениями в процессе основного курса, с длительным сохранением полостных образований, что и объясняло большую продолжительность лечения (табл. 14).
К моменту начала терапии «Фитолоном» у больных основной и контрольной групп отмечались следующие фазы специфического процесса (табл. 15).
Более чем в половине случаев у больных рагистрировались фазы рассасывания и уплотнения; фаза инфильтрации установлена у 21,7% основной и 25,0% контролной групп. Реже регистрировалась фаза распада. Это были случаи сохраняющихся после стационарного курса лечения остаточных полостей, которые регистрировались у 17,4% больных в основной и 10,0% в контрольной группе.
Таблица 13 Клинические формы туберкулеза у подростков основной и контрольной групп
|
Клинические формы |
Основная группа |
Контрольная группа |
|
ПТК |
3/13,0 |
3/15,0 |
|
ТВГЛУ |
1/4,3 |
2/10,0 |
|
Инфильтративный |
10/43,5 |
8/40,0 |
|
Очаговый |
1/4,3 |
2/10,0 |
|
Диссеминированный |
5/21,7 |
2/10,0 |
|
Плеврит |
3/13,0 |
3/15,0 |
|
ВСЕГО |
23 |
20 |
Таблица 14 Сроки лечения больных основной и контрольной групп до применения «Фитолона»
|
Группы больных в зависимости от сроков XT |
Основная |
Контрольная |
||||
|
средний срок XT, мес. |
количество больных, % |
средний срок XT, мес. |
количество больных, % |
|||
|
Менее 6 месяцев |
3,10 |
0,7 |
8/34,8 |
2,9 |
0,7 |
8/40,0 |
|
Более 6 месяцев |
12,6 |
1,1 |
15/65,2 |
11,3 |
1,0 |
12/60,0 |
|
Все больные |
9,3 |
1,2 |
23 |
7,9 |
1,2 |
20 |
На основании данных рентгенотомографического исследования патологические изменения легочной ткани, плевры и лимфатических узлов расценивались как малые и большие. Под «малыми» изменениями в легочной ткани подразумевали наличие единичных очагов размерами не более 10 мм в диаметре, в лимфатических узлах - рентгенологическую картину, соответствующую косвенным признакам ТВГЛУ. Изменения в плевре трактовались как «малые» при наличии небольшого утолщения плевры (менее 1 см), плевральных наслоениях в синусах (закругленные, сглаженные синусы), незначительной деформации купола диафрагмы спайками.
Таблица 15 Фазы процесса у больных основной и контрольной группы до назначения «Фитолона»
|
Группы больных |
Кол-во |
Рентгенологическая картина, чел. / % |
|||||||
|
большие изменения |
малые изменения |
||||||||
|
легкие |
ВГЛУ |
плевра |
Всего |
легкие |
ВГЛУ |
плевра |
Всего |
||
|
Основная |
23 |
16/69,6 |
1/4,3 |
2/8,7 |
19/82,6 |
3/13,0 |
1/4,3 |
0 |
4/17,4 |
|
Контрольная |
20 |
11/55,0 |
1/5,0 |
3/15,0 |
15/75,0 |
4/20,0 |
1/5,0 |
0 |
5/25,0 |
|
Всего |
43 |
27/62,8 |
2/4,65 |
5/11,6 |
34/79,1 |
7/16,3 |
2/4,7 |
0 |
9/20,9 |
Поскольку основное значение при оценке результатов терапии туберкулеза у подростков придается величине и характеру остаточных изменений, то рентгенологическую динамику процесса можно считать основным критерием эффективности.
Под «большими» изменениями в легочной ткани у подростков подразумевали инфильтративные и казеозно-некротические фокусы размером более 10 мм в диаметре, формирующиеся туберкулемы, множественные очаги, немногочисленные очаги, но при двусторонней локализации процесса, остаточные полости, выраженные фиброзные и цирротические изменения. Изменения во ВГЛУ расценивались как «большие» при выраженном расширении корней или средостения за счет ВГЛУ, выявлении контуров ВГЛУ, крупных кальцинатов в них. Плевральные изменения классифицировались как «большие» при толщине плевральных наслоений 1 см и более, при выходе их за пределы реберно-диафрагмальных синусов, при отсутствии визуализации купола диафрагмы, снижении прозрачности легочных полей. При наличии патологических изменений как во ВГЛУ, так и в легких и плевре у одного и того же больного оценка проводилась по преобладающим изменениям. Например, при ПТК у подростков ведущими были изменения в легочной ткани. В соответствии с представленной градацией морфологические изменения у больных до назначения «Фитолона» расценивались следующим образом (табл. 16).
Изучение рентгенологической картины больных подростков перед назначением «Фитолона» показало, что преобладали большие специфические изменения у больных как основной (82,6%), так и контрольной (75,0%) групп. В том числе большие изменения в легочной ткани отмечались у 69,6% подростков основной и 55,0% пациентов контрольной группы, т.е. в обеих группах были преобладающими. Большие изменения со стороны ВГЛУ имели по 1 больному в обеих группах и со стороны плевры - у 2 подростков основной и 3 контрольной группы. Малые специфические изменения выявлены у 17,4% подростков основной и 25% подростков контрольной группы. Следует отметить, что среди подростков с большими патологическими изменениями в легочной ткани были пациенты с остаточными полостями распада: 4 (17,4%) в основной и 2 (10,0%) в контрольной группе, а также с формирующимися ту- беркулемами - соответственно 2 (8,7%) и 1 (5%). Бактериовыделения не отмечались ни в одном случае. Этиотропная терапия проводилась соответственно форме и фазе процесса 3-2 противотуберкулезными препаратами. Наиболее часто использовали комбинации: изониазид-рифам-пициллин-пиразинамид и изониазид-пиразинамид.
Комплексная оценка результатов лечения с применением «Фитолона» выявила следующее. «Фитолон» хорошо переносился подростками, не имел побочных действий, не давал аллергических реакций. Рентгенологическая динамика за два месяца комплексной терапии с применением «Фитолона» отражена в табл. 17. Для оценки положительной динамики использовали две градации: «умеренная» и « значительная». Под «умеренной» динамикой подразумевали некоторое уменьшение и уплотнение очагов и инфильтратов, нормализацию легочного рисунка при сохранении прежней оценки изменений (большие или малые). О «значительной» динамике можно было говорить в том случае,
Таблица 16 Рентгенологическая картина у больных подростков перед назначением «Фитолона»
|
Группы больных |
Кол-во |
Рентгенологическая картина, чел./ % |
|||||||
|
большие изменения |
малые изменения |
||||||||
|
легкие |
ВГЛУ |
плевра |
всего |
легкие |
ВГЛУ |
плевра |
всего |
||
|
Основная |
23 |
16/69,6 |
1/4,3 |
2/8,7 |
19/82,6 |
3/13,0 |
1/4,3 |
0 |
4/17,4 |
|
Контрольная |
20 |
11/55,0 |
1/5,0 |
3/15,0 |
15/75,0 |
4/20,0 |
1/5,0 |
0 |
5/25,0 |
|
Всего |
43 |
27/62,8 |
2/4,65 |
5/11,6 |
34/79,1 |
7/16,3 |
2/4,7 |
0 |
9/20,9 |
когда большие изменения переходили в малые, т.е. менялась их оценка. К ней также относились случаи закрытия полостей распада, уменьшение или фрагментация туберкулем и фокусов до размеров очагов, исчезновение очагов с образованием незначительного фиброза, полное рассасывание специфических изменений.
Таким образом, положительная динамика процесса имела место у 100% больных основной группы и 60% контрольной (Р<0,05) - табл. 18. Только в контрольной группе отмечены случаи отрицательной динамики - 2 чел. (10%) и отсутствия динамики - 6 (30,0%). В то же время «значительная положительная динамика отмечена у больных основной группы по сравнению с контрольной. Среди 4 больных основной группы, имеющих полости распада, закрытие полости произошло у 1, заполнение с образованием мелкой туберкулемы - у 1, уменьшение размеров полостей - у 2 (у 1 из них полость закрылась при дальнейшем наблюдении). В контрольной группе полость распада регистрировалась у 1 больной. У нее имело место обострение процесса с появлением перифокальной инфильтрации и второй полости распада.
Таблица 17 Динамика процесса при комплексной терапии с применением «Фитолона»
|
Группы больных |
Кол-во |
Рентгенологическая динамика |
||||
|
положительная |
отсутствует |
отрицательная |
||||
|
умеренная |
значительная |
всего |
||||
|
Основная |
23 |
15/65,2 |
8/34,8 |
23/100 |
0 |
0 |
|
Контрольная |
20 |
10/50,0 |
2/10,0 |
12/60 |
6/30,0 |
2/10,0 |
|
Всего |
43 |
25/58,1 |
10/23,3 |
35/81,4 |
6/13,9 |
2/4,7 |
Непосредственный результат комплексной терапии с применением «Фитолона» (2 месяца лечения) приведен в табл. 18.
Таблица 18. Результаты комплексной терапии с применением «Фитолона» (2 месяца лечения)
|
Группы больных |
Количество |
Значительные рентгенологические изменения, чел./% |
|||||||
|
до применения «Фитолона» |
после применения «Фитолона» в комплексной терапии-П |
||||||||
|
легкие |
ВГЛУ |
плевра |
всего |
легкие |
ВГЛУ |
плевра |
Всего |
||
|
Основная |
23 |
16/69,9 |
1/4,3 |
2/8,7 |
19/82,6 |
9/39,1 |
0 |
1/4,3 |
10/43,5 |
|
Конт рольная |
20 |
11/55,0 |
1/5,0 |
3/15,0 |
15/75,0 |
7/35,0 |
1/5,0 |
3/15,0 |
11/55,0 |
|
Всего |
43 |
27/62,8 |
2/4,65 |
5/11,6 |
34/79,1 |
16/39,2 |
S,3 |
4/9,3 |
21/48,8 |
Следовательно, при включении в комплексную терапию «Фитолона» в течение двух месяцев лечения в основной группе частота выраженных рентгенологических изменений уменьшилась почти в 2 раза с 82,6% до 43,5% (Р<0,05). В контрольной группе под воздействием химиотерапии без «Фитолона» тоже произошло сокращение удельного веса больных с выраженными морфологическими изменениями, но оно не было столь значительным: с 75% до 55% (Р<0,05). Окончательные результаты лечения определялись в конце основного курса, продолжительность которого составила у подростков от 12 до 18 месяцев (табл. 19).
Таблица 19 Результаты комплексной терапии с применением «Фитолона» (конец основного курса лечения)
|
Группы больных |
Коли- чество, чел. |
Значительные рентгенологические изменения, чел./% |
|||||||
|
до применения «Фитолона» |
после применения «Фитолона» в комплексной терапии-П |
||||||||
|
легкие |
ВГЛУ |
плевра |
всего |
легкие |
ВГЛУ |
плевра |
всего |
||
|
Основная |
23 |
16/69,6 |
1/4,3 |
2/8,7 |
19/82,6 |
9/39,1 |
0 |
0 |
4/17,4 |
|
Контрольная |
20 |
11/55,0 |
1/5,0 |
3/15,0 |
15/75,0 |
7/35,0 |
0 |
3/15,0 |
10/50,0 |
|
Всего |
43 |
27/62,8 |
2/4,65 |
5/11,6 |
34/79,1 |
16/39,2 |
0 |
3/6,9 |
14/32,6 |
Большие остаточные изменения сформировались лишь у 4 пациентов основной группы (17,4%) и значительно чаще у пациентов контрольной группы - 50% (Р<0,05). У больных основной группы после прекращения приема «Фитолона» положительная динамика процесса еще продолжалась, тогда как в контрольной группе среди больных с большими остаточными изменениями (на тех же сроках лечения) рассасывание патологических изменений имело место у 1 больного из 11.
Важным показателем эффективности лечения туберкулеза является прирост массы тела больных, так как для активного специфического процесса характерно снижение этого показателя. При успешном лечении туберкулеза масса тела особенно значительно увеличивается у подростков, не только за счет уменьшения специфической интоксикации, но и за счет физиологических особенностей этого возраста (массо-ростовой скачок). Как правило, нарастание массы тела у подростков соответствует улучшению легочного процесса. Динамика массы тела у подростков отражена в табл. 20.
Изучено влияние комплексной терапии на уровень гемоглобина крови у подростков основной и контрольной групп. Оказалось, что исходный уровень гемоглобина был высоким у большинства больных. Средние цифры гемоглобина составили 136,4±2,8 г/л у больных основной группы и 137,5±2,5 г/л у больных контрольной группы. После лечения с применением «Фитолона» средний уровень гемоглобина повысился до 138,6±2,5 т/л, тогда как в контрольной группе остался прежним - 137,5±2,2 г/л (Р<0,05). В контрольной группе у 1 больной и в основной группе у 2 больных имелась анемия с уровнем гемоглобина ниже 120 т/л. Через 2 месяца у всех подростков уровень гемоглобина нормализовался. Отсутствие различий по уровню гемоглобина у больных основной и контрольной групп можно связать с тем, что у подростков не отмечалось отклонений со стороны красной крови, требующих коррекции.
В процессе проведения исследований было изучено антиоксидантное действие «Фитолона» по уровню малонового диальдегида (МДА) - одного из конечных продуктов перекисного окисления липидов (ПОЛ). МДА определяли в сыворотке крови по методу Андреевой Л.И., Кожемякина Л.А., Кишкун А.А. (1988). Для определения нормы было обследовано 18 здоровых подростков. Средний нормальный уровень МДА в плазме составил 4,46±0,20 нмоль/мл. Установлен нормальный диапазон концентрации МДА, он составил 3,61-5,31 нмоль/мл.
Таблица 20 Динамика массы тела у подростков при приеме «Фитолона» (2 месяца)
|
Группы больных |
Количество больных |
Больные с нарастанием массы тела (число/ %) |
Прибавка массы, кг (М±т) |
|
|
|
|
|
|
Основная |
23 |
1,7/73,9 |
2,12±0,30 |
|
Контрольная |
20 |
9/45,0 |
1,45±0,39 |
Определение МДА в динамике проведено у 29 больных, в том числе 13 больных основной и 16 - контрольной группы (табл. 21). В основной группе больных среднее значение МДА до начала лечения было существенно выше нормы - 5,71 ±0,35 нмоль/мл (Р<0,05). В контрольной группе этот показатель составил 5,06±0,31 нмоль/мл), что также выше нормы, но различие в ней недостоверно (Р>0,05). В результате лечения в обеих группах больных (с применением «Фитолона» и без него) произошло снижение уровня МДА (Р>0,05), причем практически на одну и ту же величину (на 0,78 нмоль/мл в основной и 0,76 нмоль/мл). Различия между исходными и конечными результатами недостоверны вследствие относительно больших колебаний в значениях МДА у отдельных больных.
Поэтому был проведен анализ динамики МДА у каждого отдельного больного в зависимости от использования «Фитолона» и клинико- рентгенологической динамики процесса (табл. 22). У больных основной группы более чем в половине случаев исходно отмечался повышенный уровень МДА (53,8%), реже - нормальный (38,5%) и.лишь у 1 (7,7%) подростка ниже нормы. В контрольной группе поровну было подростков с нормальным и повышенным уровнем МДА (43,8%) и у 2 (12,5%) - сниженным.
После курса лечения «Фитолоном» в основной группе увеличилось число больных с нормальным уровнем МДА (с 38,5% до 61,5%), уменьшилось число больных с повышенным уровнем МДА (с 53,8% до 30,8%), число больных с пониженным МДА осталось прежним - 1 (7,7%). Такая динамика МДА сопровождалась благоприятными клинико-рентгенологическими изменениями.
В контрольной группе число больных с нормальным уровнем МДА существенно не изменилось (с 41,4% до 44,8%), удельный вес больных с повышенным уровнем МДА снизился с 48,3% до 31,0%, существенно увеличился процент подростков со сниженным меньше нормы уровнем МДА (с 10,3% до 24,1%). В этой группе больных встречались лица с неблагоприятным течением процесса, причем у двух из них обострение произошло на фоне сниженных цифр МДА: 2,99-2,98 нмоль/мл. Таким образом, если в основной группе больных отмечается тенденция к нормализации уровня МДА, то в контрольной - к снижению МДА ниже нормального уровня, что указывает на дисбаланс в системе свободнорадикального окисления (СРО).
Таблица 21 Уровень МДА в динамике у больных основной и контрольной групп
|
Группа больных |
Количество обследованных, чел. |
Значение МДА, нмоль/мл (М±т) |
|
|
до лечения (1) |
после лечения (П) |
||
|
Основная |
13 |
5,71 ±0,35 |
4,93±0,33 |
|
Контрольная |
16 |
5,06±0,31 |
4,30±0,33 |
|
Норма |
18 |
4,46±0,20 |
|
Таблица 22 Динамика МДА у больных на фоне терапии с «Фитолоном» и без него
|
Группы больных |
Больные с различным уровнем МДА, чел. /% |
|||||
|
до лечения |
после лечения |
|||||
|
норма |
повышен |
понижен |
норма |
повышен |
понижен |
|
|
Основная n= 13 |
5/38,5 |
7/53,8 |
1/7,7 |
8/61,5 |
4/30,8 |
1/7,7 |
|
Контрольная n=16 |
7/43,8 |
7/43,8 |
2/12,5 |
5/31,3 |
5/31,3 |
6/37,5 |
|
Всего η = 29 |
12/41,4 |
14/48,3 |
3/10,3 |
13/44,8 |
9/31,0 |
7/24,1 |
Для подтверждения этого рассмотрена динамика МДА у больных, имевших отклонения по его уровню в начале исследования (табл.23). В основной группе после применения «Фитолона» уменьшился удельный вес больных, имеющих отклонения уровня МДА с 61,5% перед применением «Фитолона» до 38,5% после него. В контрольной группе наоборот доля таких больных несколько возросла: с 56,3% до 68,8%. В результате лечения в основной группе нормализация показателя имела место у 5 из обследованных больных (38,5%) или у 5/8 имевших отклонения. В контрольной группе соответственно нормализация произошла у 1 больного (6,25%) или у 1/9 имевших отклонения (Р<0,05). Нежелательные колебания уровня МДА в сыворотке, вероятно, были связаны не только с ходом туберкулезного процесса, но и с побочным действием антибактериальных препаратов. Таким образом, полученные данные свидетельствуют о том, что включение «Фитолона» в схему лечения туберкулеза оказывает нормализующее воздействие на процессы ПОЛ.
О влиянии «Фитолона» на иммунную систему судили по абсолютному содержанию лимфоцитов в 1 мкл периферической крови (норма не менее 1500 клеток), реакциям бласттрансформации лимфоцитов в присутствии митогена фитогемагглютинина и туберкулина (РБТЛ с ФГА и ППД). При морфологическом учете нормальные значения РБТЛ с ФГА составляют 50% и более, РБТЛ с ППД (туберкулином) - 3% и менее [26]. Кроме того использовали реакцию торможения миграции лейкоцитов (РТМЛ) как показатель интегральной функциональной активности иммунокомпетентных клеток. Определяли миграцию лейкоцитов в присутствии ППД (нормальным считали индекс миграции от 80 до 120%) и с ФГА (норма - менее 80% или более 120%). Таким образом, использованные тесты позволяли иметь представление о состоянии неспецифического (общее количество лимфоцитов, РБТЛ с ФГА, РТМЛ с ФГА) и специфического (РБТЛ с ППД, РТМЛ ППД) звеньев клеточного иммунитета.
Иммунологические показатели определяли до назначения «Фитолона» и через 2 месяца его применения на фоне общепринятой химиотерапии туберкулеза. Больным контрольной группы, не получавшим «Фитолон», проводили исследования в те же сроки. Обследованы 21 больных основной группы и 9 - контрольной, учитывали количество больных, имеющих патологические отклонения по изучаемым показателям (табл. 24). У больных, не принимавших «Фитолон», при воздействии химиопрепаратов усугубляется имеющийся дисбаланс в иммунной системе: у некоторых больных снижается количество лимфоцитов, нарушается их функциональная активность. У подростков, получавших терапию с «Фитолоном», в ряде случаев наоборот отмечается нормализация нарушенных иммунологических показателей. Следует отметить, что ни у одного больного как до, так и после лечения не было отклонений в уровне РТМЛ с ППД, поэтому данный тест в дальнейшем не рассматривался.
Поскольку оценка иммунологического статуса требует комплексного подхода, то по совокупности всех изученных данных его динамика расценивалась как «улучшение», «без динамики» и «ухудшение» (табл. 25).
Таблица 23 Влияние терапии с «Фитолоном» на нормализацию уровня МДА
|
Группы больных |
Больные, имеющие отклонения в уровне МДА, чел./% |
Нормализация уровня МДА, чел./% |
Появление отклонений в уровне МДА |
|
|
ДО лечения |
после лечения |
|
|
|
|
Основная n=13 |
8/61,5 |
5/38,5 |
5/38,5 |
2/15,4 |
|
Контрольная |
9/56,3 |
11/68,8 |
1/6,25 |
3/18,8 |
Таблица 24 Динамика иммунологических показателей при включении в комплексную терапию «Фитолона»
|
Больные, имеющие отклонения иммунологических показателей, чел./% |
||||||||
|
Группы ольных |
снижено число лимфоцитов |
снижение РБТЛ с ФГА |
повышение РБТЛ с ППД |
отклонения РТМЛ с ППД |
||||
|
ДО лечения |
После лечения |
До лечения |
После лечения |
До лечения |
После лечения |
ДО лечения |
После лечения |
|
|
Основная |
2/9,5 |
0 |
13/61,9 |
9/42,9 |
16/76,2 |
13/61,9 |
11/52,4 |
8/38,1 |
|
Контрольная |
0 |
2/27,2 |
1/11,1 |
3/30,0 |
5/55,6 |
7/77,8 |
4/44,4 |
4/44,4 |
При включении «Фитолона» в комбинированную терапию туберкулеза преобладают положительные тенденции в динамике иммунологических показателей (66,7%). У 4 человек показатели остались на прежнем уровне (19,0%), что можно также считать положительным фактором при наблюдавшейся положительной динамике туберкулезного процесса у этих больных. Лишь у 14,3% отмечалось ухудшение иммунологических показателей (Р<0,05), что, по-видимому, объясняется иммуносупрессивным действием некоторых химиопрепаратов и особенностями течения туберкулезного процесса.
У подростков, не принимавших «Фитолон», в равном числе случаев наблюдалась положительная и отрицательная динамика иммунологических показателей (44,4%). Следовательно, при включении «Фитолона» в терапию туберкулеза у подростков происходит улучшение иммунологического статуса.
Интересно отметить, что это улучшение происходит за счет как специфического, так и не специфического звеньев иммунитета, что можно связать с поливалентным действием «Фитолона».
По полученным данным, применение «Фитолона» на фоне этиотропной терапии способствует более благоприятному течению репаративных процессов, благоприятной динамике туберкулезного процесса с формированием малых остаточных изменений. У подростков, получавших «Фитолон», чаще отмечалась прибавка массы тела, что свидетельствует об его благоприятном действии на организм в целом. Он также благоприятно влияет на иммунологическую реактивность организма и баланс процессов свободно-радикального окисления, нарушенный у подростков не только вследствие специфического воспаления, но и прооксидантного действия противотуберкулезных препаратов и недостатка в пищевом рационе естественных антиоксидантов. «Фитолон» способствует нормализации показателей красной и белой крови при их снижении (анемия, лейкопения) и может применяться для лечения и профилактики этих состояний у больных туберкулезом.
Таблица 25 Комплексная оценка динамики иммунологических показателей
|
Группы |
Улучшение показателей, чел./% |
Без динамики, чел./% |
Ухудшение, чел./% |
||
|
больных |
специ фических |
неспеци фических |
В целом |
||
|
Основная |
12/57,1 |
12/57,1 |
14/66,7 |
4/19,0 |
3/14,3 |
|
Контрольная |
3/33,3 |
3/33,3 |
4/44,4 |
1/11,1 |
4/44,4 |
Проведенные исследования «Фитолона» (таблетки) позволяют рекомендовать продукт для широкого применения в качестве БАД к лечебному питанию и вспомогательного средства в патогенетической терапии туберкулеза. «Фитолон» назначается по 1 таблетке 3 раза в день в течение 2 месяцев на фоне противотуберкулезной химиотерапии. «Фитолон» не имеет побочных эффектов и противопоказаний к применению. Индивидуальную аллергическую реакцию на практике ни разу не наблюдали. С хорошими результатами был также апробирован «Фитолон», капли (спиртовой раствор), хотя считается, что таблетированная форма имеет ряд преимуществ по сравнению с каплями, благодаря более точной дозировке, отсутствию этилового спирта [25].
Изучено действие «Фитолона» в СПбГМУ им. академика И. П. Павлова на кафедре фтизиопульмонологии [11-13]. Стандартный набор гематологических показателей выполняли в лаборатории городского противотуберкулезного диспансера № 17 Фрунзенского района Санкт-Петербурга. Специальные исследования выполнены в лаборатории кафедры биохимии СПбГМУ им. академика И. П. Павлова. В работе изучение проводили по оценке динамики лабораторных гематологических показателей.
Обследован 51 больной туберкулезом органов дыхания, находившихся на лечении в стационаре городского противотуберкулезного диспансера. Группы обследованных включали 41 мужчину и 10 женщин в возрасте от 21 года до 60 лет, средний возраст основной группы - 40,2 лет, контрольной группы - 41,7 лет. Представленные клинические формы туберкулеза: инфильтративный - 18 (35,2%), диссеминированный - 22 (43,1%), казеозная пневмония - 2 (3,9%), туберкулез внутригрудных лимфатических узлов -1 (1,8%), фиброзно-кавернозный туберкулез - 8 (15,6%) больных. У 46 (90,1%) больных процесс в легких характеризовался распадом, у 39 (76,4%) - бактериовыделением. 18 (35,2%) больных выделяли устойчивые к одному или нескольким противотуберкулезным препаратам микобактерии.
Основная группа больных состояла из 33 больных, принимавших в дополнение к противотуберкулезным химиопрепаратам «Фитолон» в таблетках. Контрольная группа включала 18 больных, которые получали адекватную процессу противотуберкулезную терапию. У принимавших участие в исследовании контролировали гемограмму, уровень СМ (средних молекул) по методу Н.И. Габриэлян (1989г.), уровень ЦИК (циркулирующих иммунных комплексов) по методу П.В. Барановского и В.С. Данилишиной (1983) до и после приема «Фитолона». Средняя суточная доза Фитолона составила 4 таблетки, курс - 60 дней. В контрольной группе эти же показатели оценивали в интервале 2 месяцев. Обработку полученных данных проводили на ЭВМ с вычислением стандартных статистических показателей.
Показатели красной крови не выявили выраженной динамики ни в основной, ни в контрольной группах обследованных (табл. 26). Уровень гемоглобина по средним значениям в основной группе сохранился в пределах нормы с небольшим повышением на 2 г/л после приема Фитолона. В контрольной группе отмечена слабая тенденция к снижению содержания гемоглобина. Количество эритроцитов у больных основной группы также несколько увеличилось, тогда как в контрольной группе существенно не изменилось.
Оценка уровня лейкоцитов крови (табл.27) показала, что в пределах основной группы у части больных их количество увеличивается, у других - снижается на фоне приема «Фитолона». В связи с этим выделены 2 подгруппы больных: в первой - количество лейкоцитов возрастает параллельно с увеличением абсолютного числа лимфоцитов; во второй - снижение лейкоцитов сопровождается уменьшением абсолютного числа лимфоцитов.
Уровень СМ плазмы и эритроцитов, характеризующих выраженность эндогенной интоксикации, у больных в динамике снизился (табл. 28). Однако степень снижения различна в трех группах. Для наглядности коэффициент экстинкции СМ (Е) умножен на 100. В группе 1 и контрольной группе степень снижения СМ плазмы - в I - целых единиц, а в группе II -11 целых единиц, т.е. в 10 раз больше. СМ эритроцитов крови в группе 1 существенно не меняется, во II группе произошло значительное снижение, а в контрольной группе - повышение на 1,2 целых единиц.
При исходных величинах СМ в группах (табл.29) отмечено, что в группе II исходно были наиболее высоки значения СМ как в плазме, так и в эритроцитах крови. Следовательно, при выраженной интоксикации влияние «Фитолона» при туберкулезе наиболее отчетливо.
Таблица 26 Динамика показателей красной крови в группах обследованных
|
Показатели |
Основная группа (n=33) |
Контрольная группа (n=18) |
Норма |
||
|
исходно |
В динамике |
ИСХОДНО |
В динамике |
224/у |
|
|
Гемоглобин крови (г/л) |
126±3,3 |
128±2,8 |
120±6,8 |
117±7,7 |
120-140 |
|
Эритроциты крови (х1012/л) |
4,1 ±0,11 |
4,3±0,09 |
3,9±0,23 |
3,9±0,18 |
3,9-4,7 |
Таблица 27 Динамика показателей лейкоцитов и лимфоцитов крови в группах обследованных
|
Показатели |
Основная группа (n=12) |
Основная группа II (n=21) |
Контрольная группа (n=18) |
Норма 224/у |
|||
|
|
исходно |
В динам. |
ИСХОДНО |
В динам. |
ИСХОДНО |
В динам. |
|
|
Лейкоциты кр. (х109/л) |
6,8±0,5 |
7,2±0,7 |
7,8±0,3 |
7,3±0,6 |
6,9±0,6 |
7,1 ±0,6 |
4,0-9,0 |
|
Лимфоциты кр. (аб.в 1 мкл) |
1831±200 |
2019±182 |
1985±132 |
1906±169 |
1882±151 |
2246±337 |
1200-3000 |
Уровень ЦИК, определяющих антиген неспецифическую гуморальную иммунную защиту организма (табл. 28, 29) изменился, соответственно в I и контрольной группах - увеличение, во II группе - снижение. Принимая во внимание, что по показателям интоксикации II основная группа оказалась тяжелее, необходимо отметить влияние «Фиталона» на интенсивность неспецифической гуморальной защиты. Показатель ЦИК во II основной группе был исходно самым высоким (54,1 ±20,0) и значительно снизился (до 26,4±3,1), т.е. произошло уменьшение напряжения гуморального иммунитета. В то же время в I основной группе ЦИК повысилось, что свидетельствовало о стимуляции исходно низкого показателя. Кроме того, произошло выравнивание значений показателей ЦИК в I основной и контрольной группах в динамике.
Таблица 28 Динамика уровня СМ и ЦИК крови в группах обследованных
|
Показатели |
Основная группаI (n=12) |
Основная группа II (n=21) |
Контрольная группа (n=18) |
|
СМ плазмы (Ех100) усл.ед. |
↓ на 2,2±0,04 |
↓ на 10,9±0,02 |
↓ на 1,1 ±0,02 |
|
СМ эритроцитов (Ех100) усл.ед |
↓ на 0,3±0,05 |
↓ на 20,1 ±0,05 |
↑ на 1,9±0,04 |
|
ЦИК усл.ед. |
↑ на 20,6±8,1 |
↑ на 9,7±22,0 |
↑ на 10,8±8,4 |
Таблица 29 Показатели уровня СМ и ЦИК крови в группах обследованных
|
Показатели |
Основная группа I (n=12) |
Основная группа II (n=21) |
Контрольная группа (n=18) |
Доноры (n=13) |
|||
|
ИСХОДНО |
в динам. |
ИСХОДНО |
в динам. |
ИСХОДНО |
В динам. |
||
|
СМ плазмы (Е) усл.ед. |
0,219±0,04 |
0,197±0,02 |
0,292±0,02 |
0,180±0,02 |
0,162±0,01 |
0,138±0,01 |
0,166±0,02 |
|
СМ эрит роцитов (Е) усл.ед. |
0,532±0,04 |
0,529±0,06 |
0,772±0,04 |
0,539±0,02 |
0,537±0,04 |
0,567±0,03 |
0,465±0,01 |
|
ЦИК усл. ед. |
11,8±2,4 |
33,1±7,3 |
54,1±20,0 |
26,4±3,1 |
22,5±3,6 |
30,2±5,2 |
13,1±0,8 |
Таким образом, таблетки «Фитолон» в комплексном лечении больных туберкулезом органов дыхания позволяют достигнуть следующих результатов.
1) «Фитолон» способствует снижению уровня эндогенной интоксикации, регистрируемой по уровню СМ плазмы и эритроцитов: чем выше содержание СМ, тем отчетливее проявляется влияние «Фитолона».
2) «Фитолон» оказывает малое стимулирующее влияние на показатели красной крови, которое характеризуется небольшим увеличением количества эритроцитов и гемоглобина крови у больных туберкулезом органов дыхания.
3) Применение «Фитолона» при лечении туберкулеза не оказывало выраженного влияния на количество лейкоцитов и лимфоцитов крови: динамика показателей по данным исследования разнонаправленна.
4) «Фитолон» способствует ускорению снижения напряжения гуморального ответа организма при исходно высоком уровне ЦИК и активации его при исходно недостаточном для защиты организма.
В НИИ гриппа применяем «Фитолон» при заболеваниях органов дыхания, например в ингаляциях у взрослых больных, страдающих пневмонией, хроническим или обструктивным бронхитом, бронхиальной астмой. Спиртовой раствор «Фитолон» - капли в разведении 1:10 вводили через аппарат ГЭИ-1 при одновременной подаче кислорода. В результате лечения практически у всех пациентов улучшилась дренажная функция бронхов, уменьшилось количество лейкоцитов в мокроте, уменьшился кашель, на 30% была снижена суммарная доза антибиотиков [16].
В Детской городской больнице Св. Ольги Санкт-Петербурга в инфекционно-боксовом отделении, где спиртовой раствор «Фитолона» применяется при острых стенозирующих ларинготрахеитах (ОСЛТ) после восстановления проходимости верхних дыхательных путей, ликвидации синдрома крупа в разведении физиологическим раствором 1:10, в ультразвуковых и компрессионных ингаляторах, отмечена быстрая положительная динамика заболевания и сокращение сроков до полного выздоровления детей [28].
«Фитолон» в таблетках применяли у детей с рецидивирующими бронхолегочными заболеваниями в анамнезе, перенесших острую микоплазменую инфекцию (МПИ). В период диспансерного наблюдения за детьми, перенесшими МПИ, было проведено изучение возможности применения таблеток «Фитолон» с оздоровительной и профилактической целью. Адаптоген назначался 100 детям преимущественно с отягощённым преморбидным фоном, курсами по 3 недели и перерывами по 1 месяцу, дважды - в осенний и зимне-весенний периоды. Контрольная группа была репрезентативна и состояла из 100 человек этого же возраста. Детям, вошедшим в состав контрольной группы, каких-либо иммунокорригирующих препаратов не назначали.
При проведении второго профилактического курса дети получали «Фитолон» в течение 1 месяца в тех же дозах, что и при 1 этапе наблюдения. Показано, что на фоне «Фитолона» снижалась заболеваемость ОРЗ, реже наблюдалось вовлечение в процесс нижнего отдела дыхательного тракта примерно каждый третий ребенок не болел.
«Фитолон» использовали для профилактики также у 55 детей с бронхиальной астмой (БА) легкой и среднетяжелой формой течения, перенесших МПИ и имевших в анамнезе частые и длительно текущие ОРИ (7,3±1,3 раза в год) (табл.30).
В период повышенной заболеваемости гриппом и ОРЗ амбулаторно 35 детям с БА в периоде ремиссии в комплексную базисную противовоспалительную терапию включали «Фитолон» по 1 табл. 2 раза в день, а 20 детей вошли в состав контрольной группы, получая только базисную терапию.
За время наблюдения число случаев ОРЗ в группе детей, принимавших «Фитолон», составило 103,0%, а в контроле - 270,0%, последние болели в 2,6 раза чаще, чем дети, принимавшие БАД. Достоверно чаще в группе контроля ОРИ сопровождалась обострением БА (в 1,4 раза). Кроме того, показано, что в течение последующих трех месяцев наблюдения у детей с БА, принимавших «Фитолон», снизилась частота обострений хронических заболеваний носоглотки в 2,8 раза, что также сопровождалось удлинением ремиссии БА. Переносимость препарата была хорошей, побочных явлений не отмечалось. Применение препарата достоверно уменьшало длительность и тяжесть заболевания ОРВИ у 94,3% детей с БА.
Удобство приема, отсутствие побочных явлений, натуральное растительное сырье в качестве действующего вещества позволяет рекомендовать фитоадаптоген «Фитолон» в качестве профилактического средства, в том числе и у детей с отягощенным преморбидным фоном.
Таблица 30 Результаты изучения профилактической эффективности «Фитолона» у детей с бронхиальной астмой
|
Препарат |
Число детей |
|
Кратность |
Частота обострений |
|
|
Число ОРИ |
случаев ОРИ |
БА |
ЛОР |
||
|
«Фитолон» |
35 |
36/103,0 |
1,2 |
7/20,0 |
20/57,1 |
|
контроль |
20 |
54/270,0 |
2,7 |
6/30,0 |
32/160,0 |
|
р<0,05 |
|
+ |
|
+ |
+ |
* - в числителе абсолютное число, в знаменателе - относительные (%)
Статья из брошюры
«Применение фитоадаптогенов для профилактики и в комплексном лечении туберкулеза»
Упоминаемые в брошюре препараты: «Лесмин», «Фитолон», «Альгинат Кальция»


