Исследование эффектов грибов Cantharellus cibarius (Лисички обыкновенные) на трематоду O. felineus и на хозяина паразита – инбредных мышей C57BL/6
 М.А. Цыганов1, 2, Г.Б. Вишнивецкая1, Т.П. Кукина3, И.В. Сорокина3, М.Н. Львова1, 4, М.А. Проценко5, Н.Е. Костина1, Д.Ф. Августинович1
М.А. Цыганов1, 2, Г.Б. Вишнивецкая1, Т.П. Кукина3, И.В. Сорокина3, М.Н. Львова1, 4, М.А. Проценко5, Н.Е. Костина1, Д.Ф. Августинович1
- Федеральный исследовательский центр Институт цитологии и генетики Сибирского отделения Российской академии наук, Новосибирск, Россия
- Новосибирский национальный исследовательский государственный университет, Новосибирск, Россия
- Новосибирский институт органической химии им. Н.Н. Ворожцова Сибирского отделения Российской академии наук, Новосибирск, Россия
- Новосибирский государственный медицинский университет Минздрава России, Новосибирск, Россия
- Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора, Новосибирская область, р. п. Кольцово, Россия
КАК ЦИТИРОВАТЬ ЭТУ СТАТЬЮ:
Цыганов М.А., Вишнивецкая Г.Б., Кукина Т.П., Сорокина И.В., Львова М.Н., Проценко М.А., Костина Н.Е., Августинович Д.Ф. Исследование эффектов грибов Cantharellus cibarius на трематоду O. felineus и на хозяина паразита - инбредных мышей C57BL/6. Вавиловский журнал генетики и селекции. 2018;22(7):856-864. DOI 10.18699/VJ18.426
HOW TO CITE THIS ARTICLE:
Tsyganov M.A., Vishnivetskaya G.B., Kukina T.P., Sorokina I.V., Lvova M.N., Protsenko M.A., Kostina N.E., Avgustinovich D.F. Effects of the mushroom Cantharellus cibarius on the liver fluke O. felineus and hosting inbreed C57BL/6 mice. Vavilovskii Zhurnal Genetiki i Selektsii=Vavilov Journal of Genetics and Breeding. 2018;22(7):856-864. DOI 10.18699/VJ18.426
Описторхоз - опасное паразитарное заболевание, вызываемое трематодами семейства Opistorchiidae, в том числе видом Opisthorchis felineus, распространенным на территории Российской Федерации и Западной Европы. В наше время остается актуальным поиск новых препаратов для лечения описторхоза с максимальным противопаразитарным и минимальным побочным действием. В работе исследованы потенциальные антигельминтные эффекты экстракта грибов Лисичка обыкновенная (Cantharellus cibarius). В экспериментах in vitro показано, что при повышении концентрации экстракта C. cibarius (10-1000 мкг/мл) подвижность и выживаемость ювенильных особей O. felineus значительно снижается. В исследованиях in vivo экстракт C. cibarius, вводимый мышам инбредной линии C57BL/6 в первые сутки после инфицирования, приводил к снижению количества гельминтов в желчных протоках печени, оцениваемому через шесть недель после инфицирования.
В другой серии экспериментов введение экстракта в течение семи дней мышам с пятинедельным сроком инфицирования не оказывало антигельминтного эффекта. В обоих случаях состояние хозяина паразита, оцениваемое по ряду физиологических и биохимических параметров, не ухудшалось, что говорит об отсутствии какого-либо негативного действия экстракта C. cibarius. Полученные результаты свидетельствуют в пользу возможных антигельминтных свойств экстракта C. cibarius при применении на стадии эксцистирования личинок паразита.
Ключевые слова: Opisthorchis felineus; метанольный экстракт Cantharellus cibarius; мыши C57BL/6; биохимические показатели крови.
Effects of the mushroom Cantharellus cibarius on the liver fluke O. felineus and hosting inbreed C57BL/6 mice
M. A. Tsyganov1, 2, G.B. Vishnivetskaya1, T.P. Kukina3, I.V. Sorokina3, M.N. Lvova1, 4, M.A. Protsenko5, N. E. Kostina1, D.F. Avgustinovich1
- Institute of Cytology and Genetics, SB RAS, Novosibirsk, Russia
- Novosibirsk State University, Novosibirsk, Russia
- N.N. Vorozhtsov Novosibirsk Institute of Organic Chemistry, SB RAS, Novosibirsk, Russia
- Novosibirsk State Medical University, Novosibirsk, Russia
- State Research Center of Virology and Biotechnology “Vector" Koltsovo, Novosibirsk region, Russia
Opisthorchiasis is a dangerous parasitic disease caused by trematodes in the family Opisthorchiidae. One of the causes of this infection is the species Opisthorchis felineus, which is common in the Russian Federation and Western Europe. The disease has a large number of complications and relatively few effective treatments, so nowadays it is relevant to look for new drugs for the treatment of opisthorchiasis, with the maximum antiparasitic and minimal side effect. In this work, a potentially anthelmintic effect of the methanol extract of the golden chanterelle mushroom (Cantharellus cibarius) was investigated. In in vitro experiments, the significantly reduced mobility and survival rates of juvenile O. felineus specimens with increasing concentrations (10-1000 pg/ml) of the C. cibarius extract were shown. In in vivo studies, administration of the C. cibarius extract on the first day after parasitic infection of inbred C57BL/6 mice resulted in a decrease of the number of helminths in the bile ducts of the liver, evaluated 6 weeks after infection. In another series of experiments, administration of the C. cibarius extract for 7 days to mice infected with O. felineus for five weeks had no anthelmintic effect.
In both cases, the state of the infected hosts, evaluated by a number of physiological and biochemical parameters (relative weight of organs, blood indices), did not deteriorate, indicating that there was no adverse effect of the C. cibarius extract. The results obtained suggest that the C. cibarius extract might have anthelmintic properties if applied as parasite larvae excyst.
Key words: Opisthorchis felineus; methanolic extract of Cantharellus cibarius; C57BL/6 mice; blood biochemical markers.
Описторхоз - заболевание гепатобилиарной системы и поджелудочной железы, вызываемое трематодами семейства Opisthorchiidae, в том числе Opisthorchis felineus. В Российской Федерации самый крупный очаг O. felineus-индуцированного описторхоза - Обь-Иртышский регион, где инфицирование гельминтами городского населения достигает 80 %, а сельского - 90 % и более (Mordvinov et al., 2012; Yurlova et al., 2017). Описторхоз характеризуется воспалительными процессами в печени и желчевыводящих каналах (Sripa, 2003; Nair et al., 2011). Инфекция O. felineus обусловливает многочисленные патологии печени и поджелудочной железы: холангит, холецистит, стриктуры желчевыводящих протоков, желчекаменную болезнь, гепатитоподобные симптомы (желтуха, гепатомегалия), панкреатиты (Пальцев, 2005; Saltykova et al., 2016). Некоторые авторы отмечают корреляцию инфицирования O. felineus с онкологией гепатобилиарной системы и поджелудочной железы у человека (Бражникова, Толкаева, 2002).
В связи с масштабностью распространения описторхоза, длительностью течения и серьезными последствиями, которые он вызывает в организме инфицированных людей и животных, ведется постоянный поиск способов лечения и их апробация на лабораторных животных. Для этого описторхоз чаще всего моделируют на золотистых хомячках Mesocricetus auratus (Pinlaor et al., 2009; Pakharukova et al., 2015), которые, однако, не являются естественными хозяевами для этого вида трематод. Исследования описторхоза проводятся также на нокаутных (Nair et al., 2011) и инбредных C57BL/6 мышах (Зеленцов, 1974; Avgustinovich et al., 2016-2018; Августинович и др., 2017). Для O. felineus-инфицированных мышей C57BL/6 характерна пролонгированная (до 6 недель) стадия ювенильной мариты, что отличает их от хомячков. Это дает некоторые преимущества при исследовании хронических эффектов препаратов на неполовозрелых описторхов.
Главным и наиболее эффективным препаратом для лечения описторхоза у человека является празиквантел. Ряд авторов предполагают развитие устойчивости паразита к действию препарата (Greenberg, 2014). Также у празиквантела отмечают побочные эффекты (Erko et al., 2012) и значительное цитотоксическое влияние на клетки печени (Sripa et al., 2011). Поэтому в настоящее время остается актуальным поиск других соединений, эффективных при описторхозе. В качестве потенциального источника подобных веществ рассматривают грибы рода Лисичка (Cantharellus), в частности распространенный на территории РФ гриб Лисичка обыкновенная (C. cibarius). В природе эти грибы проявляют антинематодные свойства (Muszynska et al., 2016). Отмечено их широкое применение в народной медицине (Cieniecka-Roslonkiewicz et al., 2007), поскольку гриб содержит вещества с потенциально лекарственными свойствами при различных заболеваниях (Valverde et al., 2015; Nyman et al., 2016). Методами in vitro и in vivo установлены высокие антиоксидантные и противовоспалительные свойства экстрактов грибов, причем у алкогольных экстрактов более выраженные, чем у водных (Vamanu, Nita, 2014). Метанольный экстракт грибов имеет преимущества по сравнению с водным, поскольку оказывает противомикробное действие (Kozarski et al., 2015; Muszynska et al., 2016), а его антимикробная активность в отношении Escherichia coli в семь раз выше, чем у этанольного (Aina et al., 2012). У мышей используют однократное или хроническое внутрибрюшинное введение метанольных экстрактов C. cibarius в диапазоне доз 200-800 мг/кг (Khalili et al., 2014, 2015).
Эффективность C. cibarius при лечении описторхозных инфекций не изучалась. Поэтому целью данного исследования было определение антигельминтных свойств метанольного экстракта C. cibarius при двух режимах введения мышам инбредной линии C57BL/6: на стадии внедрения O. felineus (первые сутки инфицирования) и на стадии уже прикрепившихся к желчным протокам печени паразитов (5 недель инфицирования). Действие экстракта грибов на O. felineus оценивали также в условиях in vitro. Кроме того, предполагалось получить и сопоставить химический состав метанольного и этанольного экстрактов C. cibarius.
Материалы и методы
Животные. Половозрелые самцы мышей линии C57BL/6 были получены из Центра генетических ресурсов лабораторных животных (RFMEFI61914X005 и RFMEFI61914 X0010) ФИЦ Институт цитологии и генетики (ИЦиГ) СО РАН. Животных содержали группами по 3-6 особей в стандартных клетках 36 * 23 * 10 см при световом режиме 12:12 ч (день: ночь), температуре воздуха 24 °С, наличии корма и воды ad libitum. Все процедуры были проведены согласно директивам European Communities Council от 24.11.1986 (86/609/EEC), а также в соответствии с требованиями Комиссии по биоэтике ФИЦ ИЦиГ СО РАН (протокол № 26 от 13.03.2015).
Метацеркарии O. felineus были выделены из естественно зараженных язей (Leuciscus idus), обитающих в реке Обь в черте г. Новосибирска. Метацеркарии были промыты 0.9 % стерильным раствором NaCl и далее содержались в нем при температуре 4 °С не более суток для экспериментов in vivo и до 7 дней в стерильном растворе натрий-фосфатного буфера с добавкой антибиотика канамицина (25 мкг/мл) для экспериментов in vitro.
Экстракты C. cibarius были получены из грибов C. cibarius, собранных в Новосибирской области, и приготовлены по методике Т.П. Кукиной с соавторами (2016). Для этого высушенные при температуре не выше 40 °С грибы измельчали на электрической мельнице, далее измельченное сырье просеивали через сито с отверстиями размером 2 мм. Навеску в количестве 50 г загружали в насадку Сокслета и экстрагировали в течение 20 ч. В качестве экстрагентов использовали метанол, этанол и этанол с доэкстракцией метанолом. Полученные экстракты упаривали досуха на роторном испарителе Buchi (Швейцария) с термостатированной водяной баней при температуре 40 °С и пониженном (20-30 мм рт. ст.) давлении, обусловленном применением водоструйного насоса. В экспериментах in vivo и in vitro был использован метанольный экстракт согласно рекомендациям (Aina et al., 2012). Для исследований in vivo экстракт C. cibarius суспендировали в 10 % Tween 80, который применяется в экспериментах на животных в качестве растворителя (Teufack et al., 2017). В исследованиях in vitro экстракт растворяли в диметилсульфоксиде (DMSO).
Исследования in vitro. Эксцистирование ювенильных червей обеспечивали добавлением в раствор с личинками 0.06 % раствора трипсина (Sigma, США) с последующим содержанием в течение 15 мин при 37 °С. Затем червей пятикратно промывали инкубационной средой [состав: RPMI 1640, L-глутамин (Life Technologies, США), антибиотики (100 мкг/мл стрептомицин+100 ед/мл пенициллин, Sigma, США), антимикотик (25 мкг/мл амфотерицин В) и 1 % глюкоза] и помещали в лунки стандартного культурального планшета, содержащие 990 мкл среды и 10 мкл исследуемого вещества. Сухой экстракт грибов разводили до нужной концентрации в 100 % DMSO так, чтобы при добавлении 10 мкл в среду конечная концентрация DMSO была 1 %, а экстракта - 10, 100 или 1000 мкг/мл. На каждую концентрацию экстракта приходилось две лунки, по 60-80 ювенильных особей O. felineus в каждой. В контрольные лунки добавляли 1 % DMSO. Планшет помещали в С02-инкубатор (37 °С, 5 % СО2) на 24 ч.
Анализ подвижности ювенильных червей проводили через 24, 72, 120 и 168 ч после добавления препарата на основе методики (Keiser et al., 2013). Подвижность оценивали визуально с помощью микроскопа Axiovert 40CFL (Zeiss, Германия) по 4-балльной шкале (4 - активное непрерывное движение червя, 3 - слабо выраженные медленные движения всего тела, 2 - очень редкие движения, чаще всего ограниченные только одной областью тела, 1 - полная неподвижность), затем нормировали по контрольной группе (1 % DMSO). Через сутки после добавления препаратов вычисляли среднеэффективную концентрацию препарата, при которой происходит полное прекращение подвижности у 50 % всех червей (IC50) с помощью программы CompuSyn 1.0 (ComboSynInc).
Исследования in vivo. Были использованы две схемы введения экстракта C. cibarius инфицированным животным. В первой серии экспериментов в 18:00 половине животных были введены метацеркарии (100 личинок/мышь), находящиеся в 0.1 мл физиологического раствора, второй половине - 0.9 % NaCl. На следующий день в 10:00 однократно вводили раствор экстракта C. cibarius или растворитель (10 % Tween 80). При этом половине животных в каждой группе вводили экстракт C. cibarius, другой половине - растворитель. В каждой подгруппе было 7-14 мышей. Во второй серии экспериментов экстракт C. cibarius (или растворитель) вводили инфицированным животным ежедневно в течение 7 дней через 5 недель после введения метацеркарий O. felineus. Использовали две группы по 14-15 мышей. Вещества вводили внутрижелудочно с помощью специализированных зондов (Braintree Scientific, Inc., США). Доза препарата 600 мг/кг была выбрана, исходя из литературных данных (Khalili et al., 2014).
В ходе обоих экспериментов регистрировали массу тела животных каждые 10 дней. Через 6 недель после инфицирования мышей умерщвляли быстрой декапитацией и производили забор биоматериала для дальнейшего исследования. Печень, селезёнку и тимус взвешивали и определяли относительную массу органов в пересчете на грамм массы тела. Печень помещали в раствор 0.9 % NaCl для последующего подсчета количества паразитов в желчных протоках и желчном пузыре и определения состояния их зрелости. При обнаружении червей и анализе состояния желчных протоков печени использовали световой микроскоп Axiovert 40CFL (Zeiss, Германия) с увеличением x4. Кровь, собранную при декапитации, центрифугировали при 3 000 об/мин, 4 °С в течение 20 мин, сыворотку отделяли и хранили при -70 °С до начала биохимических исследований.
Биохимическое исследование. Активность ферментов аланинаминотрансферазы (АЛТ), аспартатаминотрансферазы (АСТ), щелочной фосфатазы (ЩФ), лактатдегидрогеназы (ЛДГ), содержание глюкозы (ГЛЮ), общего белка (ОБ), холестерина (ХОЛ), триглицеридов (ТГ) в сыворотке крови определяли с помощью стандартных наборов реактивов (Biocon, Индия). Измерения были выполнены на биохимическом полуавтоматическом анализаторе Фотометр-5010 (Boehringer Mannheim, Германия).
Исследование химического состава экстрактов C. cibarius. Содержание белка, полисахаридов, фенольных соединений, флавоноидов и каротиноидов в экстрактах C. cibarius определяли по ранее описанному методу (Проценко и др., 2018).
Статистическая обработка результатов осуществлялась с помощью пакета программ Statistica 6.0 (StatSoft). Для первой схемы введения применяли двухфакторный дисперсионный анализ: в качестве первого фактора использовали «инфицирование» (инфицированные, неинфицированные), в качестве второго - «препарат» (экстракт C. cibarius, растворитель). Для анализа эффекта экстракта по второй схеме введения использовали однофакторный дисперсионный анализ. Изменения массы тела оценивали критерием Уилкоксона для парных сравнений. Данные представлены как среднее значение ± ошибка среднего. Результаты считались статистически значимыми при p < 0.05 и на уровне тенденции при 0.05 < p < 0.1. Выживаемость паразитов в эксперименте in vitro оценивали по методу Каплана-Мейера, сравнение кривых выживаемости производили по методу х2. Кривые считались различающимися приp < 0.05.
Результаты
Исследования in vitro
В первые минуты после внесения экстракта или 1 % DMSO не было обнаружено изменений внешнего вида или активности червей. Через 24 часа подвижность червей в лунках с концентрациями экстракта 10, 100 и 1000 мкг/мл была на 6.15, 7.69 и 41.15 % соответственно меньше подвижности в контрольной группе. В дальнейшем (через 72-120 ч) подвижность червей постепенно уменьшалась. Через 120 ч в группе 10 мкг/мл подвижность была на 64 % меньше контрольной, в группе 100 мкг/мл - на 71.2 % меньше, в группе 1000 мкг/мл наблюдалось полное прекращение подвижности. Через 168 ч наступала гибель большей части червей. Подсчитанная через 24 ч после добавления препарата IC50 экстракта C. cibarius была равна 1.58 мг/мл.
На каждом этапе наблюдения производили подсчет погибших (неподвижные, непрозрачные) червей. Смертность в контрольной группе составляла 0 % через 24 ч после начала эксперимента, 9.41 % - через 72 ч, 37.65 % - через 120 ч и 87.65 % - через 168 ч. В группе с концентрацией экстракта C. cibarius 10 мкг/мл эти показатели составили 2.08, 29.86, 70.14 и 97.92 % соответственно. При концентрации экстракта 100 мкг/мл получены значения 3.96, 37.62, 77.23 и 91.19 % соответственно, а при концентрации экстракта 1000 мкг/мл - 12.08, 87.25 и 100 % через 120-168 ч. Во всех случаях графики выживаемости паразитов при введении C. cibarius статистически значимо отличались от контрольных значений (10 мкг/мл: X2 = 41.57, p = 1.14- 10-10; 100 мкг/мл: х2 = 17.33, р = = 3.13 • 10-5; 1000 мкг/мл: х2 = 227.48, р = 0.000).
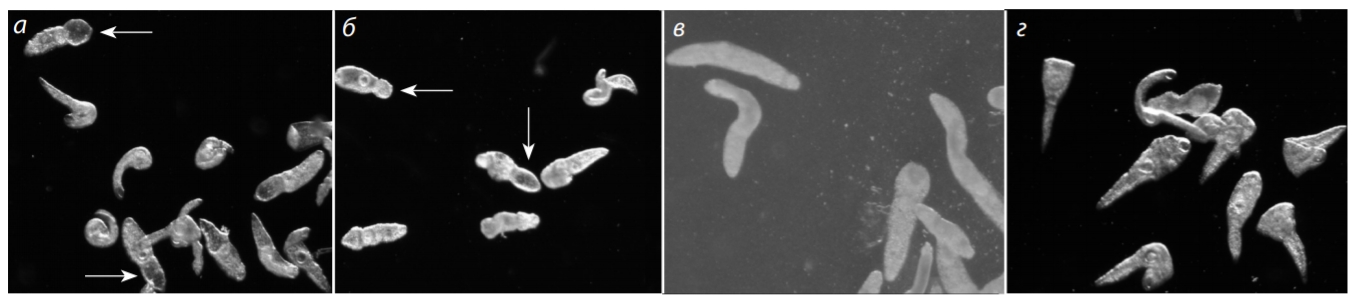
Рис. 1. Внешний вид ювенильных особей O. felineus через 72 ч после действия 10 мкг/мл (а), 100 мкг/мл (б) и 1000 мкг/мл (в) экстракта C. cibarius и растворителя (г).
Стрелки указывают на экскреторные пузыри.
Таблица 1. Относительная масса органов (мг/г) после однократного введения экстракта C. cibarius в первые сутки после инфицирования мышей O. felineus
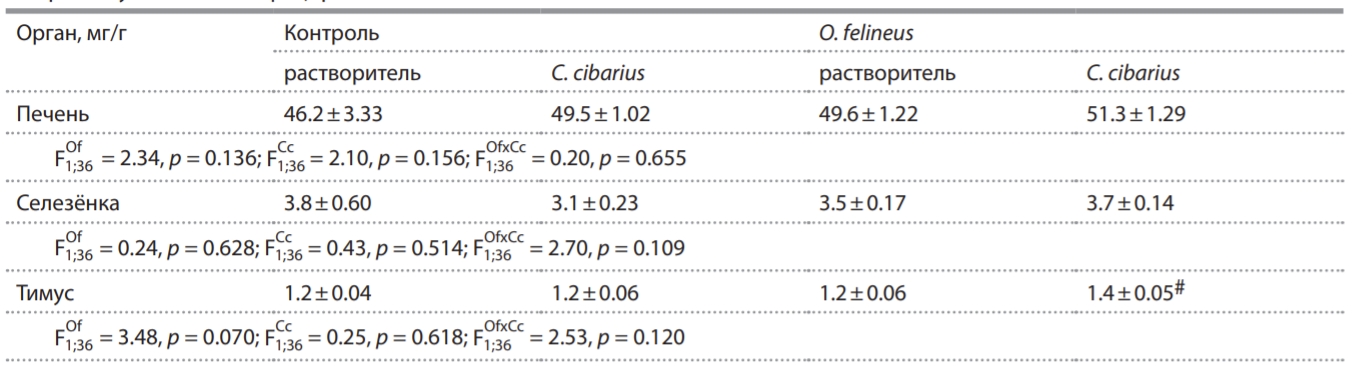
Примечание. Of - фактор «инфицирование»; Cc - фактор «препарат». #p < 0.05 по сравнению с аналогичной контрольной группой.
Обращало на себя внимание существенное изменение внешнего вида паразитов под действием препарата: у многих червей в ячейках с дозами экстракта 10 и 100 мкг/мл через 72 ч наблюдалось увеличение экскреторного пузыря (рис. 1, а, б), которое сохранялось далее. У червей контрольной группы таких изменений не было все 168 ч (см. рис. 1, г). Особи с концентрацией экстракта 1000 мкг/мл к этому сроку почти все погибли (см. рис. 1, в).
Исследования in vivo
Однократное введение экстракта C. cibarius в первые сутки после инфицирования привело к статистически значимому (F1;20 = 4.36; p = 0.048) снижению количества паразитов в желчных протоках печени животных через 6 недель после инфицирования (18.1 ± 1.5) по сравнению с этим показателем в контрольной группе (23.5 ± 2.2). При исследовании под микроскопом не обнаружено существенных изменений внешнего вида паразитов, выделенных из печени мышей с введением и без введения экстракта C. cibarius. Черви были преимущественно неполовозрелые, с хорошо визуализируемыми двумя ветвями кишечника. В обеих группах у одного из животных обнаружено по одной половозрелой особи O. felineus.
У мышей исследуемых групп не установлено значимого влияния факторов «инфицирование» и «препарат» на относительную массу печени и селезёнки; взаимодействия факторов не было (табл. 1). Отмечено увеличение массы тимуса у O. felineus-инфицированных животных, получавших экстракт C. cibarius, по сравнению с аналогичными мышами контрольной группы.
Не обнаружено влияния экстракта C. cibarius на прирост массы тела животных за 6 недель эксперимента: в каждой подгруппе мыши в равной степени набирали вес, который увеличился в среднем на 2.5-3 г.
Во второй серии экспериментов введение экстракта C. cibarius в течение 7 дней через 5 недель после инфицирования не вызывало статистически значимого изменения количества паразитов (26.2 ± 0.89 - C. cibarius, 28.4 ± 1.85 - растворитель; F1;29 = 1.16, р = 0.292). При этом черви, выделенные из желчных протоков после введения растворителя и экстракта C. cibarius, различались: у последних был существенно увеличен экскреторный пузырь (рис. 2, а, б). У всех мышей обнаруженные черви были неполовозрелыми, с хорошо визуализируемыми двумя ветвями кишечника. И только у двух в каждой группе мышей было обнаружено по одной половозрелой особи O. felineus (см. рис. 2, в).
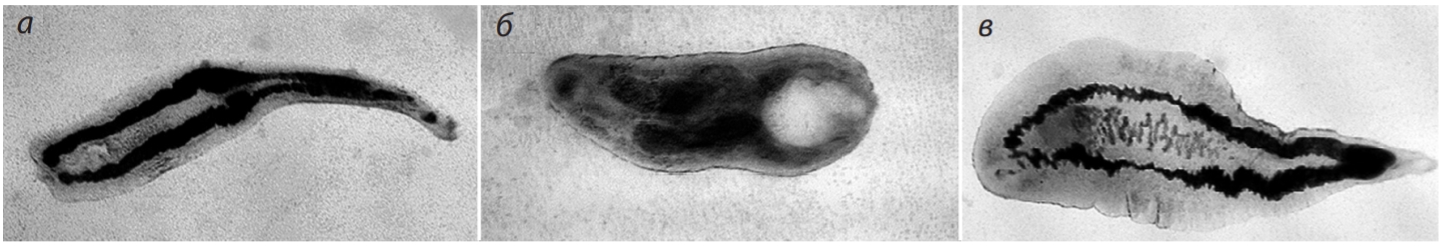
Рис. 2. Внешний вид особей O. felineus, выделенных из печени мышей: а - контрольная группа; б - группа, получавшая экстракт C. cibarius; в - половозрелая особь O. felineus.
Таблица 2. Биохимические показатели крови контрольных и O. felineus-инфицированных мышей после однократного введения веществ
|
Показатель |
Контроль |
O. felineus |
||
|
Растворитель |
C. cibarius |
Растворитель |
C. cibarius |
|
|
АЛТ, ед/л |
47.3 ± 6.15 |
45.6 ± 5.67 |
88.0 ± 9.40# |
92.3 ± 13.87## |
|
АСТ, ед/л |
199.0 ± 26.17 |
184.4 ± 13.68 |
275.2 ± 33.15# |
283.8 ± 19.14## |
|
ЩФ, ед/л |
256.8 ± 19.91 |
209.2 ± 11.38* |
282.3 ± 14.96 |
265.7 ± 13.22## |
|
ЛДГ, ед/л |
2873.3 ± 223.36 |
3140.9 ± 264.29 |
4190.0 ± 475.53# |
4299.3 ± 290.81## |
|
ГЛЮ, ммоль/л |
11.0 ± 0.78 |
10.0 ± 0.47 |
10.0 ± 0.36 |
9.1 ± 0.32 |
|
ОБ, г/л |
88.3 ± 1.99 |
83.3 ± 5.63 |
90.8 ± 1.54 |
86.7 ± 2.02 |
|
ХОЛ, ммоль/л |
3.5 ± 0.23 |
3.0 ± 0.43 |
2.8 ± 0.26 |
2.9 ± 0.19 |
|
ТГ, ммоль/л |
0.3 ± 0.04 |
0.2 ± 0.03 |
0.2 ± 0.02® |
0.2 ± 0.01 |
* p < 0.05 - по сравнению с растворителем;
# p < 0.05;
## p < 0.01; 0.05 < p < 0.1 - по сравнению с аналогичной контрольной группой.
При 7-дневном введении не выявлено различий между животными, получавшими экстракт C. cibarius, и мышами контрольной группы по относительной массе печени (F1;29 = 2.10, р = 0.159) (51.6 ± 1.07 мг/г - контроль; 48.5 ± 1.75 мг/г - C. cibarius) и селезёнки (F1;29 = 2.85, р = 0.103) (3.1 ± 0.09 мг/г - контроль; 3.4 ± 0.15 мг/кг - C. cibarius). Межгрупповых различий по массе тела в начале (F1;29 = 0.036, р = 0.851) и в конце (F1;29 = 1.24, р = 0.275) эксперимента не было. При этом в обеих группах обнаружено снижение массы тела мышей за период введения препаратов (7 дней): с 28.0 ± 0.50 до 26.6 ± 0.46 г у контрольной группы мышей (р = 0.000) и с 28.2 ± 0.58 до 27.2 ± 0.42 г у мышей, получавших экстракт C. cibarius (р = 0.015).
Биохимический анализ крови
Результаты биохимических исследований у инфицированных и неинфицированных мышей, которым однократно вводили C. cibarius либо растворитель, приведены в табл. 2. Двухфакторным дисперсионным анализом не установлено влияния фактора «препарат» на активность АЛТ (FCc1;35 = 0.01, p = 0.915), АСТ (FCc1;35 = 0.02, p = 0.898) и ЛДГ [FCc1;35 = 0.29, p = 0.591). Влияние фактора «инфицирование» было значимым и при введении экстракта C. cibarius, и при введении растворителя (АЛТ: FOf1;35 = = 13.16, p = 0.001; АСТ: FOf1;35 = 14.06, p = 0.001; ЛДГ: FOf1;35 = 12.68, p = 0.001). Взаимодействия факторов не выявлено (АЛТ: FCcxOf1;35 = 0.06, p = 0.805; АСТ: FCcxOf1;35 = = 0.25, p = 0.623; ЛДГ: FCcxOf1;35 = 0.05, p = 0.821). Для ЩФ установлено достоверное влияние как фактора «инфицирование» (FOf1;35 = 7.35, p = 0.010), так и фактора «препарат» (FCc1;35 = 451, p = 0.041) при отсутствии взаимодействия факторов (FCcxOf1;35 = 1.06, p = 0.311). Как показало последующее post hoc сравнение, в группе неинфицированных животных активность ЩФ снижалась при введении экстракта C. cibarius, чего не наблюдалось у инфицированных мышей. Более того, на фоне введения экстракта C. cibarius у инфицированных мышей обнаружена значительно более высокая автивность ЩФ, чем у неинфицированных. Влияния факторов «препарат» и «инфицирование» на уровень глюкозы были статистически значимыми (FCc 1;35 = 4.54, p = 0.040; FOf 1;35 = = 4.23, p = 0.047 соответственно), взаимодействия факторов не было (FCcxOf 1;35 = 0.01, p = 0.937). Однако post hoc сравнение не выявило каких-либо различий между группами. Не обнаружено влияния фактора «препарат» и на содержание общего белка (FCc 1;35 = 1.45, p = 0.237), триглицеридов (FCc 1;35 = 0.10, p = 0.757) и холестерина (FCc 1;35 = 0.34, p = 0.565). Фактор «инфицирование» (FOf 1;35 = 4.22, p = 0.047) обусловливал заметное, но статистически незначимое снижение уровня ТГ на фоне введения растворителя (p = 0.072). Влияния инфицирования на содержание белка и холестерина в крови не обнаружено (FOf 1;35 = 0.61, p = 0.441; FOf 1;35 = 1.65, p = 0.207). По всем трем показателям взаимодействие факторов отсутствовало (ОБ: FCcxOf 1;35 = 0.01, p = 0.914; ТГ: FCcxOf 1;35 = 0.85, p = 0.362; ХОЛ: FCcxOf 1;35 = 0.87, p = 0.357). В табл. 3 приведены результаты биохимических исследований у инфицированных мышей, которым вводили растворитель либо экстракт C. cibarius ежедневно в течение 7 дней через 5 недель инфицирования. По всем оцениваемым показателям, кроме содержания глюкозы в крови, мыши сравниваемых групп не различались (АЛТ: F1;27 = 0.01, p = 0.936; АСТ: F1;27 = 1.14, p = 0.295; ЩФ: F1;27 = 0.04, p = 0.838; ЛДГ: F1;27 = 2.64, p = 0.116; ОБ: F1;27 = 1.28, p = 0.268; ХОЛ: F1;27 = 0.004, p = 0.951; ТГ: F1;27 = 0.004, p = 0.949). Экстракт C. cibarius статистически значимо повышал уровень глюкозы (F1;37 = 5.35, p = 0.029).
Таблица 3. Биохимические показатели крови у O. felineus-инфицированных мышей после 7-дневного введения веществ
|
Показатель |
Растворитель |
C. cibarius |
|
АЛТ, ед/л |
61.0 ± 7.74 |
60.2 ± 5.02 |
|
АСТ, ед/л |
232.1 ± 22.94 |
206.0 ± 10.04 |
|
ЩФ, ед/л |
274.5 ± 13.58 |
270.8 ± 11.77 |
|
ЛДГ, ед/л |
3933.6 ± 308.83 |
3418.7 ± 103.66 |
|
ГЛЮ, ммоль/л |
8.3 ± 0.30 |
9.1 ± 0.21* |
|
ОБ, г/л |
84.5 ± 0.83 |
83.0 ± 1.10 |
|
ХОЛ, ммоль/л |
2.9 ± 0.10 |
2.8 ± 0.27 |
|
ТГ, ммоль/л |
0.2 ± 0.01 |
0.2 ± 0.01 |
* p < 0.05 по сравнению с растворителем.
Таблица 4. Композиционный состав экстрактов C. cibarius при трех способах экстрагирования
|
Полисахариды |
Суммарный белок |
Фенольные соединения |
Флавоноиды |
Каротиноиды, |
|
|
мг/г |
мкг/г |
||||
|
Этанольный |
89.4 ± 6.2 |
13.7 ± 1.3 |
1.95 ± 0.10 |
< 5 |
22.3 |
|
Метанольный |
82.3 ± 3.5 |
12.0 ± 0.8 |
2.47 ± 0.10 |
< 5 |
3.2 |
|
Этанольно-метанольный |
148.0 ± 4.7 |
< 5 |
4.42 ± 0.12 |
< 5 |
6.0 |
В табл. 3 приведены результаты биохимических исследований у инфицированных мышей, которым вводили растворитель либо экстракт C. cibarius ежедневно в течение 7 дней через 5 недель инфицирования. По всем оцениваемым показателям, кроме содержания глюкозы в крови, мыши сравниваемых групп не различались (АЛТ: F127 = 0.01, p = 0.936; АСТ: F127 = 1.14, p = 0.295; ЩФ: Fj;27 = 0.04, p = 0.838; ЛДГ: Fj.27 = 2.64, p = 0.116; ОБ: f;27 = 1.28, p = 0.268; ХОЛ: F127 = 0.004, p = 0.951; ТГ: F127 = 0.004,p = 0.949). Экстракт C. cibarius статистически значимо повышал уровень глюкозы (F1 37 = 5.35, p = 0.029).
Состав экстрактов C. cibarius
В результате анализа состава различных экстрактов C. cibarius было обнаружено, что при метанольной экстракции лучше выделяются фенольные соединения, а при этанольной - каротиноиды (табл. 4). Повторная экстракция в этаноле после метанольной экстракции способствует увеличению количества полисахаридов и фенольных соединений, но сопровождается значительной потерей белка. Во всех трех случаях экстрагирования выделено одинаковое и незначительное количество флавоноидов.
Обсуждение
В настоящей работе нами получены первые данные по антигельминтной активности экстракта C. cibarius на модели O. felineus-индуцированного описторхоза у мышей. Для экстрактов C. cibarius ранее были показаны противовоспалительные эффекты (Vamanu, Nita, 2014), инсектицидная активность (Cieniecka-Roslonkiewicz et al., 2007), антиоксидантные и гепатопротекторные свойства - уменьшение фибротических изменений в печени при индуцированном воспалении (Aina et al., 2012; Khalili et al., 2014, 2015), а также цитотоксические эффекты на раковые клетки в условиях in vitro (Sari et al., 2017). Учитывая это, можно было ожидать возможного угнетающего действия C. cibarius непосредственно на гельминта.
В экспериментах in vitro показано, что выживаемость и подвижность ювенильных особей O. felineus существенно снижаются с увеличением дозы экстракта C. cibarius в инкубационной среде. Через 120 ч после начала эксперимента активно двигающиеся описторхи были только в контрольной группе. Увеличение экскреторного пузыря у паразитов тоже свидетельствует в пользу антигельминтной активности C. cibarius: сходные морфологические изменения наблюдали при действии празиквантела (Pakharukova et al., 2015). Полагают, что празиквантел нарушает метаболизм паразита, действуя на белки мембранного транспорта, в том числе белки экскреторной системы паразита (Greenberg, 2014). Возможно, экстракт C. cibarius также оказывает эффект на работу экскреторной системы O. felineus.
Показатель IC50 экстракта C. cibarius (1.58 мг/мл) намного превышает значения IC50 других клинически применяемых препаратов, таких как празиквантел (IC50 = 0.33 мкг/мл при действии на ювенильных и 0.14 мкг/мл - на взрослых особей) (Pakharukova et al., 2015) или используемый при клонорхозе трибендимидин (IC50 = 0.05 мкг/мл при действии на взрослых особей) (Keiser et al., 2013). Возможно, это объясняется тем, что в состав использованного экстракта C. cibarius входят соединения, которые могут обладать самостоятельными потенциальными антигельминтными свойствами, но их количество в экстракте незначительно. Такими веществами C. cibarius могут быть специфические бета-глюканы - иммуномодуляторы с цитотоксическим действием на опухолевые клетки (El Enshasy, Hatti-Kaul, 2013; Valverde et al., 2015; Sari et al., 2017), эргостерол - стероид грибов с известными антиоксидантными свойствами, а также фенольные соединения, например мирицетин и катехин, участвующие в антиоксидантных процессах (Ebrahimzadeh et al., 2015; Valverde et al., 2015; Muszynska et al., 2016). Некоторые авторы подчеркивают высокую активность флавоноидов (Kozarski et al., 2015). Установленный нами состав экстракта C. cibarius свидетельствует о присутствии значительного количества полисахаридов, среди которых преобладают бета-глюканы (Muszynska et al., 2016), и в меньших количествах - флавоноидов и фенольных соединений. Эргостерол был ранее обнаружен в составе экстрактов C. cibarius другими исследователями (Muszynska et al., 2016).
В модели in vivo было установлено пролонгирование ювенильной стадии развития паразита у мышей по сравнению с хомячками, обнаруженное нами и ранее (Avgustinovich et al., 2017, 2018). Почти все паразиты были неполовозрелыми - просматривались только две ветви кишечника, отсутствовали половые органы. У естественных хозяев (человек, кошка) паразиты через месяц инфицирования становятся половозрелыми (Беер, 2005). Это может указывать на существование у мышей особых механизмов резистентности к инфицированию O. felineus. В группах мышей с введением растворителя и экстракта C. cibarius при обеих схемах введения найдено лишь по одной половозрелой особи. Поэтому можно предположить, что на фоне естественного развития червя экстракт не влияет на созревание особей O. felineus. Обнаруженное расширение экскреторного пузыря червей после введения мышам экстракта C. cibarius, аналогичное наблюдавшемуся в исследованиях in vitro, еще раз свидетельствует об антигельминтном влиянии экстракта C. cibarius на паразита.
Следует подчеркнуть, что однократное введение экстракта C. cibarius в первые сутки после инфицирования вызывало статистически значимое снижение количества червей в желчных протоках животных. Таким образом, впервые показан возможный превентивный антигельминтный эффект экстракта C. cibarius на модели O. felineus-индуцированного описторхоза. При 7-дневном введении экстракта C. cibarius спустя 5 недель после инфицирования статистически значимого изменения количества паразитов в желчных протоках печени мышей не было. Вероятно, через некоторое время после миграции O. felineus в желчные протоки они становятся невосприимчивыми к эффектам экстракта C. cibarius даже в условиях более длительного введения. Следовательно, экстракт C. cibarius препятствует закреплению червей на стенках желчных протоков и способствует их вымыванию, но не эффективен против закрепившегося паразита. Однако мы не исключаем, что один из компонентов экстракта при большей его концентрации может оказать антигельминтный эффект и на более поздних стадиях инфицирования.
Под действием экстракта C. cibarius не наблюдалось изменений относительной массы печени, селезёнки и тимуса как у интактных, так и у инфицированных животных при обеих схемах введения экстракта. Это говорит о том, что экстракт не оказывает видимого токсического действия на организм животных. Так как у инфицированных животных, получавших экстракт C. cibarius, был увеличен относительный вес тимуса по сравнению с получавшими экстракт неинфицированными животными, то можно предположить, что при паразитарных инфекциях экстракт C. cibarius способен стимулировать Т-клеточный иммунитет.
Экстракт C. cibarius не препятствовал нормальному приросту массы тела у животных в условиях однократного введения, что предполагает отсутствие каких-либо негативных эффектов на организм хозяина паразита. Наблюдавшееся снижение массы тела мышей при недельном введении экстракта C. cibarius связано, скорее всего, с влиянием ежедневного стресса от процедуры введения веществ, что отмечают и другие авторы (Charmandari et al., 2005).
Инфицирование O. felineus вызывало повышение активности АЛТ, АСТ, ЛДГ. Такие изменения отмечают как при описторхозе, так и при других воспалительных процессах в печени (Wonkchalee et al., 2012). При этом введение экстракта C. cibarius не нормализовало, но и не ухудшало эти параметры. Можно предположить, что экстракт не оказывает негативного действия при однократном введении сразу после инфицирования животных, а также у мышей контрольной группы. В качестве положительного эффекта можно рассматривать снижение активности ЩФ, что указывает на возможное антихолестазное действие экстракта, поскольку повышение активности ЩФ наблюдают при хроническом описторхозе и других заболеваниях, вызывающих застой желчи (Dechakhamphu et al., 2010). Не исключено, что снижение активности ЩФ у неинфицированных животных под действием экстракта обусловлено N-глюканами, которые рассматриваются в качестве потенциальных иммуномодуляторов (Sari et al., 2017).
Семидневное введение экстракта C. cibarius, судя по биохимическим показателям крови, также не оказывало заметного лечебного эффекта на инфицированных животных, но при этом не отмечено и негативного влияния экстракта. Наблюдаемый повышенный уровень глюкозы в крови животных может быть обусловлен стрессом от процедуры введения препаратов.
Таким образом, проведенное исследование выявило антигельминтный эффект экстракта C. cibarius при введении в первые сутки после инфицирования животных личинками O. felineus. При этом в условиях in vitro и in vivo показано нарушение жизнедеятельности паразитов, визуально выражающееся в увеличении экскреторного пузыря. Наблюдаемый антигельминтный эффект предполагает большую эффективность экстракта на стадии эксцистирования паразита. Отсутствие нарушений динамики массы тела и органов у животных, а также биохимических показателей крови свидетельствует об отсутствии каких-либо побочных эффектов у исследуемого экстракта грибов. Необходимо дальнейшее изучение отдельных компонентов экстракта C. cibarius с оценкой их антигельминтных свойств.
Благодарности
Исследование проведено при поддержке РФФИ (грант № 17-04-00790) и бюджетного проекта отделения генетики животных и человека ИЦиГ СО РАН (№ 0324-2018-0016).
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов.
Список литературы / References
Августинович Д.Ф., Вишнивецкая Г.Б., Пирожкова Д.С., Цыганов М.А., Вавилин В.А., Пахарукова М.Ю., Шилов А.Г., Дударев В.Г., Мордвинов В.А. Влияние П-(4-метил-3-хлорфенил)-2-ацетокси-3,5-дихлорбензамида на половозрелых и ювенильных особей O. felineus в условиях in vitro и in vivo. Сиб. науч. мед. журн. 2017;37(3):17-26. [Avgustinovich D.F., Vishnivetskaya G.B., Pirozhkova D.S., Tsyganov M.A., Vavilin V.A., Pakharukova M.Y., Shilov A.G., Dudarev V.G., Mordvinov V.A. Influence of N-(4-methyl-3-chlorophenyl)-2-acetoxy-3,5-dichlorobenzamide on adult and juvenile of O. felineus worms in vitro and in vivo. Sibirskyy Nauchnyy Meditsynskyy Zhurnal = The Siberian Scientific Medical Journal. 2017;37(3):17-26. (in Russian)]
Беер С.А. Биология возбудителя описторхоза. М.: Т-во науч. изданий КМК, 2005. [Beer S.A. Biology of the Agent of Opisthorchiasis. Moscow: KMK Publ., 2005. (in Russian)]
Бражникова Н.А., Толкаева М.В. Рак печени, желчных путей и поджелудочной железы при хроническом описторхозе. Бюл. Сиб. медицины. 2002;2:71-76. [Brazhnikova N.A., Tolkaeva M.V. Cancer of liver, biliary tracts, and pancreas at chronic opisthorchiasis. Bulleten Sibirskoy Meditsyny = Bulletin of Syberian Medicine. 2002;2:71-76. (in Russian)]
Зеленцов А.Г. Восприимчивость линейных мышей к гельминтам. II. Развитие Opistorchis felineus у мышей линий А/Не, CBA/Lac, CC57M/Mv, C57B1/6J, DBA/2J, SWR/J. Мед. паразитология и паразитар. болезни. 1974;43(1):95-98. [Zelentsov A.G. Susceptibility of inbred mice to helminths. II. Development of Opisthorchis felineus in mice of strains A/He, CBA/Lac, CC57w/MJ, C57BL/LJ, DBA/2J, and SWR/J. Meditsinskaya Parazitologiya i Parazitarnye Bolezni = Medical Parasitology and Parasitical Diseases. 1974; 43(1):95-98. (in Russian)]
Кукина Т.П., Щербаков Д.Н., Геньш К.В., Тулышева Е.А., Сальникова О.И., Гражданников А.Е., Колосова Е.А. Биоактивные компоненты древесной зелени облепихи Hippophae rhamnoides L. Химия растит. сырья. 2016;1:37-42. DOI 10.14258/jcprm. 2016011100. [Kukina T.P., Shcherbakov D.N., Gensh K.V., Tulysheva E.A., Salnikova O.I., Grazhdannikov A.E., Kolosova E.A. Bioactive constituents from sea buckthorn Hippophae rhamnoides L. tree green. Khimiya Rastitelnogo Syr’ya = Chemistry of Plant Raw Material. 2016;1:37-42. DOI 10.14258/jcprm.2016011100. (in Russian)]
Пальцев А.И. Хронический описторхоз с позиций системного подхода. Клиника, диагностика, патоморфоз, лечение. Рус. мед. журн. 2005;2:96-101. [Pal’tsev A.I. Chronic opisthorchiasis from the viewpoint of the system approach: Clinical picture, diagnostics, pathomorphism, and treatment. Russkyy Meditsynskyy Zhurnal = Russian Medical Journal. 2005;2:96-101. (in Russian)]
Проценко М.А., Костина Н.Е., Теплякова Т.В. Подбор питательных сред для глубинного культивирования дереворазрушающего гриба Daedaleopsis tricolor (Bull.) Bondartsev et Singer. Биотехнология. 2018;34(1):45-51. [Protsenko M.A., Kostina N.E., Teplyakova T.V. Selection of nutrient media for submerged culturing of wood-degrading mushroom of Daedaleopsis tricolor (Bull.) Bondartsev et Singer. Biotekhnologiya = Biotechnology. 2018; 34(1):45-51. (in Russian)]
Aina D.A., Jonathan S.G., Olawuyi O.J., Ojelabi D.O., Durowoju B.M. Antioxidant, antimicrobial and phytochemical properties of alcoholic extracts of Cantharellus cibarius - a Nigerian mushroom. N. Y. Sci. J. 2012;5(10):114-120.
Avgustinovich D.F., Katokhin A.V., Kontsevaya G.V., Lvova M.N., Vishnivetskaya G.B., Kashina E.V., Marenina M.K., Maksimova G.A., Zav’yalov E.V., Mordvinov V.A. A comparative study of Opistrorchis felineus (Rivolta, 1884) infection in inbred C57BL/6 and outbred CD-1 mice. Parasitologiya. 2018;52(1):19-31.
Avgustinovich D.F., Marenina M.K., Zhanaeva S.Y., Tenditnik M.V., Katokhin A.V., Pavlov K.S., Sivkov A.Y., Vishnivetskaya G.B., Lvova M.N., Tolstikova T.G., Mordvinov V.A. Combined effects of social stress and liver fluke infection in a mouse model. Brain Behav. Immun. 2016;53:262-272. DOI 10.1016/j.bbi.2016.01.012.
Avgustinovich D.F., Orlovskaya I.A., Toporkova L.B., Vishnivetskaya G.B., Katokhin A.V., Lvova M.N., Kashina E.V., Bondar N.P., Feofanova N.A., Mordvinov V.A. Experimental opisthorchiasis: study of blood cell composition, hematopoiesis, and startle reflex in laboratory animals. Russ. J. Genet. Appl. Res. 2017;7(1):82-92.
Charmandari E., Tsigos T., Chrousos G. Endocrinology of the stress response. Annu. Rev. Physiol. 2005;67:259-284. DOI 10.1146/ annurev.physiol.67.040403.120816.
Cieniecka-Rosfonkiewicz A., Sas A., Przybysz E., Morytz B., Syguda A., Pernak J. Ionic liquids for the production of insecticidal and microbicidal extracts of the fungus Cantharellus cibarius. Chem. Biodiversity. 2007;4:2218-2224. DOI 10.1002/cbdv.200790179.
Dechakhamphu S., Pinlaor S., Sitthithaworn P., Nair J., Bartsch H., Yongvanit P. Lipid peroxidation and etheno DNA adducts in white blood cells of liver fluke-infected patients: protection by plasma a-tocopherol and praziquantel. Cancer Epidemiol. Biomarkers Prev. 2010;19(1):310-318. DOI 10.1158/1055-9965.
Ebrahimzadeh M.E., Safdari Y., Khalili M. Antioxidant activity of different fractions of methanolic extract of the golden chanterelle mushroom Cantharellus cibarius (higher basidiomycetes) from Iran. Int. J. Med. Mushrooms. 2015;17(6):557-565. DOI 10.1615/ IntJMedMushrooms.v17.i6.60.
El Enshasy H.A., Hatti-Kaul R. Mushroom immunomodulators: unique molecules with unlimited applications. Trends Biotechnol. 2013; 31(12):668-677. DOI 10.1016/j.tibtech.2013.09.003.
Erko B., Degarege A., Tadesse K., Mathiwos A., Legesse M. Efficacy and side effects of praziquantel in the treatment of Schistosomiasis mansoni in schoolchildren in Shesha Kekele Elementary School, Wondo Genet, Southern Ethiopia. Asian Pac. J. Trop. Biomed. 2012; 2(3):235-239. DOI 10.1016/S2221-1691(12)60049-5.
Greenberg R.M. Schistosome ABC multidrug transporters: From pharmacology to physiology. Int. J. Parasitol. Drugs Drug Resist. 2014; 4(3):301-309. DOI 10.1016/j.ijpddr.2014.09.007.
Keiser J., Adelfio R., Vargas M., Odermatt P., Tesana S. Activity of tribendimidine and praziquantel combination therapy against the liver fluke Opisthorchis viverrini in vitro and in vivo. J. Helminthol. 2013;87(2):252-256. DOI 10.1017/S0022149X12000387.
Khalili M., Ebrahimzadeh M.A., Kosaryan M., Abbasi A., Azadbakht M. Iron chelation and liver disease healing activity of edible mushroom (Cantharellus cibarius), in vitro and in vivo assays. RSC Adv. 2015;5:4804-4810.
Khalili M., Ebrahimzadeh M.A., Omrani F., Karami M. Antihypoxic activities of the golden chanterelle mushroom, Cantharellus cibarius (higher Basidiomycetes). Int. J. Med. Mushrooms. 2014;16(4):339-344.
Kozarski M., Klaus A., Vunduk J., Zizak Z., Niksic M., Jakovljevic D., Vrvic M.M., Van Griensven L.J.L.D. Nutraceutical properties of the methanolic extract of edible mushroom Cantharellus cibarius (Fries): primary mechanisms. Food Funct. 2015;6:1875-1886. DOI 10.1039/c5fo00312a.
Mordvinov V.A., Yurlova N.I., Ogorodova L.M., Katokhin A.V. Opisthorchis felineus and Metorchis bilis are the main agents of liver fluke infection of humans in Russia. Parasitol. Int. 2012;61(1):25- 31. DOI 10.1016/j.parint.2011.07.021.
Muszynska B., Kafa K., Firlej A., Sufkowska-Zlaja K. Cantharellus cibarius - culinary-medicinal mushroom content and biological activity. Acta Pol. Pharm. 2016;73(3):589-598.
Nair N.N., Bommana A., Pakala S.B., Ohshiro K., Lyon A.J., Suttiprapa S., Periago M.V., Laha L., Hotez P.J., Bethony J.M., Sripa B., Brindley P.J., Kumar R. Inflammatory response to liver fluke Opisthorchis viverrini depends on host-master coregulator, MTA1, a marker for parasite induced cholangiocarcinoma. Hepatology. 2011;54(4):1388-1397. DOI 10.1002/hep.24518.
Nyman A.A.T., Aachmann F.T., Rise F., Balance S., Samuelsen A.B.C. Structural characterization of a branched (1^6)-a-mannan and P-glucans isolated from the fruiting bodies of Cantharellus cibarius. Carbohydr. Polym. 2016;146:197-207. DOI 10.1016/j.carbpol.2016. 03.052.
Pakharukova M.Y., Shilov A.G., Pirozhkova D.S., Katokhin A.V., Mordvinov V.A. The first comprehensive study of praziquantel effects in vivo and in vitro on European liver fluke Opisthorchis felineus (Trematoda). Int. J. Antimicrob. Agents. 2015;46(1):94-100. DOI 10.1016/j.ijantimicag.2015.02.012.
Pinlaor S., Prakobwong S., Boonmars T., Wongkham C., Pinlaor P., Hiraku Y. Effect of praziquantel treatment on the expression of matrix metalloproteinases in relation to tissue resorption during fibrosis in hamsters with acute and chronic Opisthorchis viverrini infection. Acta Trop. 2009;111(2):181-191. DOI 10.1016/j.actatropica. 2009.04.011.
Saltykova I.V., Petrov V.A., Logacheva M.D., Ivanova P.G., Merzlikin N.V., Sazonov A.E., Ogorodova L.M., Brindley PJ. Biliary microbiota, gallstone disease and infection with Opisthorchis felineus. PLoS Negl. Trop. Dis. 2016;10(7):e0004809. DOI 10.1371/journal. pntd.0004809.
Sari M., Prange A., Lelley J.L., Hambitzer R. Screening of beta-glucan contents in commercially cultivated and wild growing mushrooms. Food Chem. 2017;216:45-51. DOI 10.1016/j.foodchem.2016. 08.010.
Sripa B. Pathobiology of opisthorchiasis: an update. Acta Trop. 2003;
88(3):209-220. DOI 10.1016/j.actatropica.2003.08.002.
Sripa B., Bethony J.M., Sithithaworn P., Kaewkes S., Mairiang E., Loukas A., Mulvenna J., Laha T., Hotez PJ., Brindley PJ. Opisthorchiasis and Opisthorchis-associated cholangiocarcinoma in Thailand and Laos. Acta Trop. 2011;120(1):158-168. DOI 10.1016/j.actatropica. 2010.07.006.
Teufack S.E.N., Tayo G.N.M., Alidou M.N., Yondo J., Djiomene A.F., Pone J.W., Mbida F.M. Anthelminthic properties of methylene chlo
ride-methanol (1:1) extracts of two Cameroonians medicinal plants on Heligmosomoides bakeri (Nematoda: Heligmosomatidea). BMC Complement. Altern. Med. 2017;17:400. DOI 10.1186/s12906-017-1908-8.
Valverde M.E., Hernandez-Perez T., Paredes-Lopez O. Edible mushrooms: improving human health and promoting quality life. Int. J. Microbiol. 2015;Art. ID 376387. DOI 10.1155/2015/376387.
Vamanu E., Nita S. Bioactive compounds, antioxidant and anti-inflammatory activities of extracts from Cantharellus cibarius. Rev. Chim. 2014;65(3):372-379.
Wonkchalee O., Boonmars T., Aromdee C., Laummaunwai P., Khunkitti W., Vaeteewoottacharn K., Sriraj P., Aukkanimart R., Loilome W., Chamgramol Y., Pairojkul C., Wu Z., Juasook A., Sudsarn P. Antiinflammatory, antioxidant and hepatoprotective effects of Thunbergia laurifolia Linn. on experimental opisthorchiasis. Parasitol. Res. 2012;111(1):353-359. DOI 10.1007/s00436-012-2846-5.
Yurlova N.I., Yadrenkina E.N., Rastyazhenko N.M., Serbina E.A., Glupov V.V. Opisthorchiasis in Western Siberia: epidemiology and distribution in human, fish, snail, and animal populations. Parasitol. Int. 2017;66(4):355-364. DOI 0.1016/j.parint.2016.11.017.
ORCID ID
M.A. Tsyganov orcid.org/0000-0003-0377-5453 M.A.
Protsenko orcid.org/0000-0002-1995-7588
Товары из статьи:
Антигельминт-Био плюс - грибы лисички обыкновенные, капсулы
В наличии
2588 руб. Со скидкой: 2070 руб.

